عملية كاستنر-كلنر Castner–Kellner process
عملية كاستنر-كلنر (Castner–Kellner process)، هي طريقة للتحليل الكهربائي لمحاليل الكلوريد القلوية المائية (عادةً محلول كلوريد الصوديوم) لإنتاج الهيدروكسيد القلوي المقابل،[1] اخترعها الأمريكي هاملتون كاستنر والنمساوي كارل كلنر في ع. 1890.[2][3] وهي نوع من عملية الكلور-القلوي، لكن في هذا الدور تُستبدل تدريجياً بالتحليل الكهربائي الغشائي الذي يتميز بتكلفة طاقة أقل ومخاوف بيئية أقل.[4]
التاريخ
مُنحت أول براءة اختراع للتحليل الكهربائي للمحلول الملحي في إنگلترة عام 1851 لتشارلز وات. إلا أن طريقته لم تكن مجدية اقتصادياً لإنتاج هيدروكسيد الصوديوم، إذ لم تمنع الكلور المتكون في المحلول الملحي من التفاعل مع مكوناته الأخرى. حل الكيميائي والمهندس الأمريكي هاملتون كاستنر مشكلة المزج باختراع بطارية الزئبق، وحصل على براءة اختراع أمريكية عام 1894.[5] توصل الكيميائي النمساوي كارل كلنر إلى حل مماثل في نفس الوقت تقريباً. لتجنب أي نزاع قانوني، أصبحا شريكين عام 1895، وأسسا شركة كاستنر-كلنر للقلويات، التي بنت مصانع تستخدم هذه العملية في جميع أنحاء أوروپا. ولا تزال عملية بطارية الزئبق مستخدمة حتى يومنا هذا.[6] تتعرض عمليات مصانع بطاريات الزئبق الحالية لانتقادات لأنها تتسبب في إطلاق الزئبق في البيئة[7] مما يؤدي في بعض الحالات إلى تسمم شديد بالزئبق (كما حدث في اليابان). ونظاًا لهذه المخاوف، يجري التخلص تدريجياً من مصانع بطارية الزئبق، وتُبذل جهود متواصلة للحد من انبعاثات الزئبق من المصانع القائمة.[8]
تفاصيل العملية
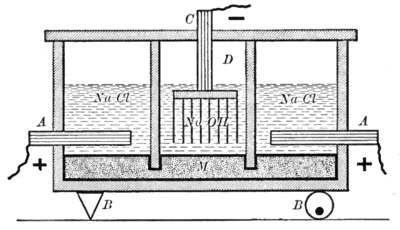
ينقسم الجهاز الموضح إلى نوعين من البطاريات، تفصل بينهما جدران من الأردواز. النوع الأول، الموضح على يمين ويسار الرسم التخطيطي، يستخدم كهرلاً من محلول كلوريد الصوديوم، ومصعداً من الگرافيت (A)، ومهبطاً من الزئبق (M). أما النوع الآخر من البطاريات، الموضح في وسط الرسم التخطيطي، فيستخدم كهرلاً من محلول هيدروكسيد الصوديوم، ومصعداً من الزئبق (M)، ومهبطاً من الحديد (D). قطب الزئبق مشترك بين البطاريتين. ويتحقق ذلك بانخفاض الجدران الفاصلة بين البطاريتين عن مستوى الكهارل مع السماح للزئبق بالتدفق أسفلها.[9]
يكون التفاعل عند المصعد (A) كالتالي:
- 2 Cl− → Cl2 + 2 e−
يتسرب غاز الكلور الناتج إلى أعلى البطارية الخارجية حيث يُجمع كناتج ثانوي للعملية. ويكون التفاعل عند مهبط الزئبق في البطاريات الخارجية كالتالي:
- Na+ + e− → Na (الملغمة)
يذوب فلز الصوديوم الناتج عن هذا التفاعل في الزئبق ليشكل ملغمة. ينقل الزئبق التيار الكهربائي من البطاريات الخارجية إلى البطارية المركزية. بالإضافة إلى ذلك، تعمل آلية اهتزاز (يمثلها الرمز B بنقطة ارتكاز على اليسار ومحور دوران لامركزي على اليمين) على تحريك الزئبق لنقل فلز الصوديوم المذاب من البطاريات الخارجية إلى البطارية المركزية.
يحدث تفاعل المصعد في البطارية المركزية عند الواجهة بين الزئبق ومحلول هيدروكسيد الصوديوم.
- 2Na (الملغمة) → 2Na+ + 2e−
وأخيراً، عند مهبط الحديد (D) للبطارية المركزية، يحدث التفاعل التالي:
- 2H2O + 2e− → 2OH− + H2
النتيجة النهائية هي انخفاض تركيز كلوريد الصوديوم في البطارية الخارجية، وزيادة تركيز هيدروكسيد الصوديوم في البطارية المركزية. مع استمرار العملية، يُسحب محلول هيدروكسيد الصوديوم من البطارية المركزية كناتج مخرج، ويُستبدل بالماء. يُضاف كلوريد الصوديوم إلى البطاريات الخارجية ليحل محل ما تم تحليله كهربائياً.
انظر أيضاً
المصادر
- ^ Pauling, Linus; General Chemistry 1970 ed. pp. 539–541 Dover publishing
- ^ Trinder, Barrie Stuart; Stratton, Michael (2000). Twentieth century industrial archaeology. London: E&FN Spon. pp. 80–81. ISBN 978-0-419-24680-0.
- ^ "The Electrolysis of Brine". Salt and the Chemical Revolution. Salt Manufacturers' Association. Archived from the original on May 14, 2007.
- ^ "Mercury".
- ^ {{{1}}} patent {{{2}}}
- ^ Kiefer, David M. (April 2002). "When the Industry Charged Ahead". Today's Chemist at Work. Chemistry Chronicles. American Chemical Society. 11 (3): 9.
- ^ "Chlorine Plants: Major, Overlooked Source of Mercury Pollution". Oceana. Archived from the original on 20 Jul 2011.
- ^ "World Chlorine Council Submission on Global Mercury Partnership for the Reduction of Mercury in the Chlor-alkali Sector" (PDF). Archived from the original (PDF) on 2011-05-25.
- ^ Newell, Lyman C.; Descriptive Chemistry p. 291; D. C. Heath and company, 1903