عملية الكلور-القلوي Chloralkali process

عملية الكلور-القلوي أو عملية الكلور-قلوي (chloralkali process)، هي عملية صناعية لتحليل محاليل كلوريد الصوديوم (NaCl) كهربائياً. وهي التكنولوجيا المستخدمة في إنتاج الكلور وهيدروكسيد الصوديوم (الصودا الكاوية)،[1] وهي مواد كيميائية أساسية مطلوبة في القطاع الصناعي. وقد تم تحضير خمسة وثلاثين مليون طن من الكلور بهذه الطريقة عام 1987.[2] عام 2022، ارتفع هذا الإنتاج إلى حوالي 97 مليون طن. ويُستخدم الكلور وهيدروكسيد الصوديوم الناتجان عن هذه العملية على نطاق واسع في الصناعات الكيميائية.
عادةً ما تُجرى العملية باستخدام الماء الأجاج (محلول مائي من كلوريد الصوديوم المركز)، وفي هذه الحالة ينتج هيدروكسيد الصوديوم (NaOH) والهيدروجين والكلور. عند استخدام كلوريد الكالسيوم أو كلوريد البوتاسيوم، تحتوي المنتجات على الكالسيوم أو البوتاسيوم بدلاً من الصوديوم. ومن العمليات المشابهة المعروفة استخدام كلوريد الصوديوم المنصهر لإنتاج الكلور والصوديوم، أو كلوريد الهيدروجين المكثف لإنتاج الهيدروجين والكلور.
تستهلك هذه العملية طاقة عالية، على سبيل المثال، حوالي 2500 كيلوواط/ساعة من الكهرباء لكل طن من هيدروكسيد الصوديوم المُنتَج. ولأن العملية تُنتج كميات مكافئة من الكلور وهيدروكسيد الصوديوم (مولان من هيدروكسيد الصوديوم لكل مول من الكلور)، فمن الضروري إيجاد استخدامات لهذه المنتجات بنفس النسبة. لكل مول من الكلور المُنتَج، يُنتَج مول واحد من الهيدروجين. يُستخدم معظم هذا الهيدروجين لإنتاج حمض الهيدروكلوريك، الأمونيا، وپروكسيد الهيدروجين، أو يُحرَق لإنتاج الطاقة و/أو البخار.[3]
التاريخ
تُستخدم عملية الكلور-القلوي منذ القرن التاسع عشر وهي صناعة أساسية في الولايات المتحدة وغرب أوروپا واليابان.[4][5] وأصبحت المصدر الرئيسي للكلور خلال القرن العشرين.[6] عملية بطارية الحجاب الحاجز وعملية بطارية الزئبق يجري استخدامهما لأكثر من 100 عام لكنهما غير صديقتين للبيئة لاستخدامهما الأسبستوس والزئبق، على التوالي. إن عملية البطارية الغشائية، والتي تم تطويرها خلال السنوات الستين الماضية فقط، هي طريقة متفوقة بفضل كفاءة الطاقة المحسنة وعدم وجود المواد الكيميائية الضارة.[5]
على الرغم من أن أول تحضير للكلور عن طريق التحليل الكهربائي للمحلول الملحي يُعزى إلى الكيميائي وليام كرويكشانك عام 1800، إلا أنه بعد 90 عاماً أُستخدمت طريقة التحليل الكهربائي بنجاح على نطاق تجاري. بدأ الإنتاج على نطاق صناعي عام 1892.[7] وفي عام 1833، صاغ فاراداي القوانين التي تحكم التحليل الكهربائي للمحاليل المائية، وصدرت براءات اختراع لكوك ووات عام 1851 ولستانلي عام 1853 لإنتاج الكلور كهربائياً من المحلول الملحي.[7]
أنظمة العملية
تُستخدم ثلاث طرق إنتاج. فبينما تُنتج طريقة بطارية الزئبق هيدروكسيد الصوديوم الخالي من الكلور، فإن استخدام عدة أطنان من الزئبق يُسبب مشاكل بيئية خطيرة. ففي دورة الإنتاج العادية، تُطلق مئات الكيلوجرامات من الزئبق سنوياً، وتتراكم في البيئة. إضافة إلى ذلك، فإن الكلور وهيدروكسيد الصوديوم الناتجين عن عملية الكلور-القلوي ببطارية الزئبق ملوثان بكميات ضئيلة من الزئبق. أما طريقة الغشاء والحجاب الحاجز فلا تستخدم الزئبق، لكن هيدروكسيد الصوديوم يحتوي على الكلور الذي يجب إزالته.
البطارية الغشائية
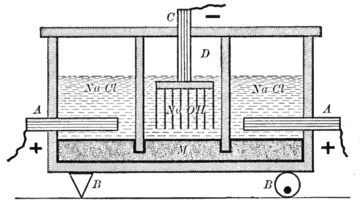
تتضمن عملية الكلور-القلوي الأكثر شيوعاً التحليل الكهربائي لمحلول كلوريد الصوديوم المائي (أجاج) في بطارية غشائية. يُستخدم غشاء، مثل النافيون Nafion أو الفلميون Flemion أو الأسيپلكس Aciplex، لمنع التفاعل بين أيونات الكلور والهيدروكسيد.

يُمرَّر المحلول الملحي المشبع إلى الغرفة الأولى من البطارية. ونظراً لارتفاع تركيز أيونات الكلوريد في المحلول الملحي، تتأكسد أيونات الكلوريد عند المصعد، فتفقد إلكتروناتها لتتحول إلى غاز الكلور (A في الرسم التوضيحي):
- 2Cl− → Cl 2 + 2e−
عند المهبط، تُختزل أيونات الهيدروجين الموجبة المسحوبة من جزيئات الماء بواسطة الإلكترونات التي يوفرها التيار الكهربائي، إلى غاز الهيدروجين، مما يؤدي إلى إطلاق أيونات هيدروكسيد في المحلول (C في الرسم التوضيحي):
- 2H 2O + 2e− → H2 + 2OH−
الغشاء المُنفِذ لتبادل الأيونات في مركز الخلية يسمح فقط لأيونات الصوديوم (Na+) بالمرور إلى الغرفة الثانية حيث تتفاعل مع أيونات الهيدروكسيد لتنتج الصودا الكاوية (NaOH) (B' في الشكل):[1]
Na+ + OH− → NaOH
وبالتالي فإن التفاعل الكلي للتحليل الكهربائي للمحلول الملحي هو:
- 2NaCl + 2H 2O → Cl 2 + H 2 + 2NaOH
بطارية الحجاب الحاجز
في عملية بطارية الحجاب الحاجز، توجد غرفتان مفصولتان بغشاء نافذ، غالباً ما يكون مصنوعاً من ألياف الأسبستوس. يُدخل المحلول الملحي إلى غرفة المصعد ويتدفق إلى غرفة المهبط. وعلى غرار البطارية الغشائية، تتأكسد أيونات الكلوريد عند المصعد لإنتاج الكلور، وعند المهبط، ينقسم الماء إلى صودا كاوية وهيدروجين. يمنع الحجاب الحاجز تفاعل الصودا الكاوية مع الكلور. يخرج محلول ملحي كاوي مخفف من الخلية. يجب عادةً تركيز الصودا الكاوية إلى 50% وإزالة الملح. يتم ذلك باستخدام عملية تبخير بحوالي ثلاثة أطنان من البخار لكل طن من الصودا الكاوية. يمكن استخدام الملح المنفصل عن المحلول الملحي الكاوي لتشبع المحلول الملحي المخفف. يحتوي الكلور على الأكسجين ويجب تنقيته غالباً عن طريق التسييل والتبخير.
بطارية الزئبق
في عملية بطارية الزئبق، المعروفة أيضاً بعملية كاستنر-كلنر، تحتوي كل بطارية كهرلية "خارجية" على مصعد مغمور في محلول ملحي، يطفو على طبقة من الزئبق. تحتوي كل بطارية "داخلية" على مصعد في محلول هيدروكسيد الصوديوم، يطفو على طبقة الزئبق نفسها. تحتوي الجدران الفاصلة بين البطاريات على فجوات أسفل سطح طبقة الزئبق. يسمح هذا للزئبق بالتدفق بين البطاريات، ويمنع المحاليل المائية من ذلك.
في البطارية "الخارجية"، تتأكسد أيونات الكلوريد عند المصعد، منتجةً غاز الكلور الذي يتصاعد من البطارية. تعمل طبقة الزئبق كمهبط، وهنا تُختزل أيونات الصوديوم في المحلول الملحي لتكوين ملغمة. بمجرد دخول الملغمة، تنطلق ذرات الصوديوم بحرية إلى البطارية "الداخلية".
في البطارية "الداخلية"، تعمل طبقة الزئبق الآن كمصعد. تتأكسد ذرات الصوديوم في الملغمة وتدخل المحلول المائي. في هذه الأثناء، عند المهبط، ينقسم الماء إلى غاز الهيدروجين وأيونات الهيدروكسيد.
يتم التخلص التدريجي من بطاريات الزئبقي بسبب المخاوف المتعلقة بالسمية العالية للزئبق وتسمم الزئبق الناتج عن تلوث بطاريات الزئبق كما حدث في كندا (انظر مرض ميناماتا في أونتاريو) واليابان (انظر مرض ميناماتا).
البطارية غير المقسمة
ينتج عن التفاعل الكلي الأولي غازات الهيدروكسيد والهيدروجين والكلور:[8]
- 2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
بدون غشاء، تكون أيونات OH− الناتجة عند المهبط حرة الانتشار في جميع أنحاء الإلكتروليت. ومع ازدياد قاعدية الكهرل نتيجة إنتاج أيونات OH−، تقل كمية Cl2 الخارجة من المحلول، حيث يبدأ في تفاعل عدم التناسب لتكوين أيونات الكلوريد والهيپوكلوريت عند المصعد:
- Cl2 + 2 NaOH → NaCl + NaClO + H2O
كلما زادت فرصة تفاعل جزيء Cl2 مع NaOH في المحلول، يقل ظهور Cl2 على سطح المحلول، ويتسارع إنتاج الهيپوكلوريت. يعتمد ذلك على عوامل مثل درجة حرارة المحلول، ومدة تلامس جزيء Cl2 مع المحلول، وتركيز هيدروكسيد الصوديوم.
وبالمثل، عندما يزداد تركيز الهيپوكلوريت، تُنتج منه الكلورات:
- 3 NaClO → NaClO3 + 2 NaCl
يتسارع هذا التفاعل عند درجات حرارة تزيد عن 60 درجة مئوية تقريباً. تحدث تفاعلات أخرى، مثل التأين الذاتي للماء وتحلل هيپوكلوريت المهبط، ويعتمد معدل هذا الأخير على عوامل مثل الانتشار ومساحة سطح المهبط الملامس للكهرل.[9]
إذا انقطع التيار أثناء غمر المهبط، فإن المهابط التي تتعرض للهجوم بواسطة الهيپوكلوريت، مثل تلك المصنوعة من الصلب المقاوم للصدأ، سوف تتحلل إلى خلايا غير مقسمة.
إذا لم يكن إنتاج غازي الهيدروجين والأكسجين من الأولويات، فإن إضافة 0.18% من كرومات الصوديوم أو البوتاسيوم إلى الكهرل سييحسن كفاءة إنتاج المنتجات الأخرى.[9]
الأقطاب الكهربائية
نظراً للطبيعة التآكلية لإنتاج الكلور، يجب أن يكون المصعد (حيث يتكون الكلور) غير تفاعلي ومصنوع من مواد مثل فلز مثل الپلاتين،[10] الگرافيت (في زمن فاراداي كان يسمى "پلومباگو")،[10] أو الماگنتيت المطلي بالپلاتين.[11] في المعيار الصناعي الحالي، يُعد قطب التيتانيوم المغطى بخليط من الأكسيد والفلز (ويُسمى أيضاً المصعد مستقر الأبعاد). تاريخياً، كان الپلاتين، والماگنتيت، وثاني أكسيد الرصاص،[12] وثاني أكسيد المنجنيز، والسليكون الحديدي (13-15% سليكون[13]) تستخدم أيضاً كمصاعد.[14] يعتبر الپلاتين الممزوج بالإريديوم أكثر مقاومة للتآكل الناتج عن الكلور من الپلاتين النقي.[14][15] لا يمكن استخدام التيتانيوم غير المغطى كمصعد لأنه يتأنّد، مكوناً أكسيد غير موصل، ويُخمّد. ينحل الگرافيت ببطء نتيجة لإنتاج غاز التحليل الكهربائي الداخلي الناتج عن طبيعة المادة المسامية، وتكوّن ثاني أكسيد الكربون نتيجة لأكسدة الكربون، مما يتسبب في تعليق جزيئات دقيقة من الگرافيت في الكهرل، والتي يمكن إزالتها بالترشيح. يمكن صنع المهبط (حيث يتشكل الهيدروكسيد) من التيتانيوم غير المخلوط، أو الگرافيت، أو من فلز أسهل تأكسداً مثل الصلب المقاوم للصدأ أو النيكل.
اتحادات المنتجين
تُمثل مصالح مصنعي منتجات الكلور-القلوي على المستويات الإقليمية والوطنية والدولية من خلال جمعيات مثل يورو كلور والمجلس العالمي للكلور.
انظر أيضاً
- عملية الكلور القلوي
- قطب انتشار الغاز
- عملية سولڤاي، وهي طريقة صناعية مماثلة لتحضير كربونات الصوديوم من كربونات الكالسيوم وكلوريد الصوديوم
المراجع
- ^ أ ب Fengmin Du; David M Warsinger; Tamanna I Urmi; et al. (2018). "Sodium hydroxide production from seawater desalination brine: process design and energy efficiency". Environmental Science & Technology. 52 (10): 5949–5958. Bibcode:2018EnST...52.5949D. doi:10.1021/acs.est.8b01195. hdl:1721.1/123096. PMID 29669210.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ R. Norris Shreve; Joseph Brink (1977). Chemical Process Industries (4th ed.). p. 219. ASIN B000OFVCCG.
- ^ Crook, Jedidiah; Mousavi, Aliyar (2016-07-02). "The chlor-alkali process: A review of history and pollution". Environmental Forensics. 17 (3): 211–217. Bibcode:2016EnvFo..17..211C. doi:10.1080/15275922.2016.1177755. ISSN 1527-5922. S2CID 99354861.
- ^ أ ب "The chlor-alkali process: A review of history and pollution". ResearchGate (in الإنجليزية). Retrieved 2020-10-05.
- ^ "Chlor-alkali process". Encyclopedia Britannica (in الإنجليزية). Retrieved 2020-10-05.
- ^ أ ب O'Brien, Thomas F.; Bommaraju, Tilak V.; Hine, Fumio, eds. (2005). "History of the Chlor-Alkali Industry". Handbook of Chlor-Alkali Technology (in الإنجليزية). Boston, MA: Springer. pp. 17–36. doi:10.1007/0-306-48624-5_2. ISBN 978-0-306-48624-1. Retrieved 2020-10-05.
- ^ Tilley, R.J.D. (2004). Understanding solids: the science of materials. John Wiley and Sons. pp. 281–. Bibcode:2004usts.book.....T. ISBN 978-0-470-85276-7. Retrieved 22 October 2011.
- ^ أ ب Thompson, M. de Kay (1911). Applied Electrochemistry. The MacMillan Company. pp. 89-90.
- ^ أ ب Faraday, Michael (1849). Experimental Researches In Electricity. Vol. 1. London: The University of London.
- ^ Landolt, D.; Ibl, N. (1972). "Anodic chlorate formation on platinized titanium". Journal of Applied Electrochemistry. Chapman and Hall Ltd. 2 (3): 201–210. doi:10.1007/BF02354977. S2CID 95515683.
- ^ Munichandraiah, N.; Sathyanarayana, S. (1988). "Insoluble anode of α-lead dioxide coated on titanium for electrosynthesis of sodium perchlorate". Journal of Applied Electrochemistry. Chapman and Hall Ltd. 18 (2): 314–316. doi:10.1007/BF01009281. S2CID 96759724.
- ^ Dinan, Charles (1927-10-15). The Corrosion of Durion Anodes (BSc). Massachusetts Institute of Technology. p. 4. hdl:1721.1/87815. Retrieved 2019-09-25.
- ^ أ ب Hale, Arthur (1918). The Applications of Electrolysis in Chemical Industry. Longmans, Green, and Co. p. 13. Retrieved 2019-09-15.
- ^ Denso, P. (1902). "Untersuchungen über die Widerstandsfähigkeit von Platiniridium-Anoden bei der Alkalichlorid-Elektrolyse". Zeitschrift für Elektrochemie. 8 (10): 149–150. doi:10.1002/bbpc.19020081004.
للاستزادة
- Bommaraju, Tilak V.; Orosz, Paul J.; Sokol, Elizabeth A.(2007). "Brine Electrolysis." Electrochemistry Encyclopedia. Cleveland: Case Western Reserve University.