كبريتيد النحاس الأحادي
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Copper(I) sulfide
| |
| أسماء أخرى | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.040.751 |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Cu 2S |
| كتلة مولية | 159.16 g/mol |
| الكثافة | 5.6 g/cm3[1][صفحة مطلوبة] |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | insoluble[citation needed] |
| قابلية الذوبان في hydrochloric acid | slightly soluble[citation needed][كمية] |
| قابلية الذوبان في ammonium hydroxide | soluble[citation needed][كمية] |
| المخاطر[3] | |
| صفحة بيانات السلامة | Sigma-Aldrich[2] |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Nonflammable |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH):[4] | |
PEL (المسموح)
|
TWA 1 mg/m3 (as Cu) |
REL (الموصى به)
|
TWA 1 mg/m3 (as Cu) |
IDLH (خطر عاجل)
|
TWA 100 mg/m3 (as Cu) |
| مركبات ذا علاقة | |
أنيونات أخرى
|
|
كاتيونات أخرى
|
|
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
Copper(I) sulfide is a copper sulfide, a chemical compound of copper and sulfur. It has the chemical formula of Cu
2S. It is found in nature as the mineral chalcocite. It has a narrow range of stoichiometry ranging from Cu
1.997S to Cu
2.000S.[5] Samples are typically black.[citation needed]
التحضير والتفاعلات
Cu
2S can be prepared by treating copper with sulfur or H
2S.[6] The rate depends on the particle size and temperature.[7]
Cu
2S reacts with oxygen to form SO
2:[8][صفحة مطلوبة]
- 2 Cu
2S + 3 O
2 → 2 Cu
2O + 2 SO
2
The production of copper from chalcocite is a typical process in extracting the metal from ores. Usually, the conversion involves roasting, to give Cu
2O as an intermediate which is further reduced to the metal, and sulfur dioxide:[8][صفحة مطلوبة]
- Cu
2S + O
2 → 2 Cu + SO
2
Copper(I) oxide readily converts to copper(II) oxide when heated in the presence of oxygen, and to copper metal upon heating in a reducing environment. (cf. Carbothermic reduction)
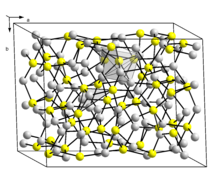
البنية
اتحادية العناصر
Two forms (a dimorphism) of Cu
2S are known. The so-called low temperature monoclinic form ("low-chalcocite") has a complex structure with 96 copper atoms in the unit cell.[9] The hexagonal form, stable above 104 °C (219 °F),[10][صفحة مطلوبة] has 24 crystallographically distinct Cu atoms. Its structure has been described as approximating to a hexagonal close packed array of sulfur atoms with Cu atoms in planar 3 coordination. This structure was initially assigned an orthorhombic cell due to the twinning of the sample crystal.
عدم اتحادية العناصر
As illustrated by the mineral djurleite, a cuprous sulfide is also known.[مطلوب توضيح] With the approximate formula Cu
1.96S, this material is non-stoichiometric (range Cu
1.934S-Cu
1.965S and has a monoclinic structure with 248 copper and 128 sulfur atoms in the unit cell.[9] Cu
2S and Cu
1.96S are similar in appearance and hard to distinguish one from another.[11]
الانتقال بين الأطوار
The electrical resistivity increases abruptly at the phase transition point around 104 °C (219 °F), with the precise temperature depending on the stoichiometry.[12][13]
انظر أيضاً
- كبريتيد النحاس for an overview of all copper sulfide phases
- أحادي كبريتيد النحاس، CuS
- كالكوسيت
- Djurleite
- LK-99 - مركب قـُيـِّم في 2023 لاحتمال موصلية فائقة
المراجع
- ^ Patnaik, Pradyot (2003). Handbook of inorganic chemicals. New York: McGraw-Hill. ISBN 0-07-049439-8.
- ^ "Copper (I) sulfite, SDS". Sigma-Aldrich. Retrieved 18 July 2025.
- ^ Sigma-Aldrich Co., Copper(I) sulfide. Retrieved on 18-07-2025.
- ^ "NIOSH Pocket Guide to Chemical Hazards".
- ^ Potter, R. W. (1977). "An electrochemical investigation of the system copper-sulfur". Economic Geology. 72 (8): 1524–1542. Bibcode:1977EcGeo..72.1524P. doi:10.2113/gsecongeo.72.8.1524.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةGreenwood - ^ Blachnik R., Müller A. (2000). "The formation of Cu2S from the elements I. Copper used in form of powders". Thermochimica Acta. 361: 31. doi:10.1016/S0040-6031(00)00545-1.
- ^ أ ب Wiberg, Egon; Wiberg, Nils; Holleman, A. F. (2001). Inorganic chemistry (1st English ed.). San Diego : Berlin ; New York: Academic Press ; De Gruyter. ISBN 0-12-352651-5.
- ^ أ ب Evans, H. T. (1979). "Djurleite (Cu1.94S) and Low Chalcocite (Cu2S): New Crystal Structure Studies". Science. 203 (4378): 356–8. Bibcode:1979Sci...203..356E. doi:10.1126/science.203.4378.356. PMID 17772445. S2CID 6132717.
- ^ Wells, A. F. (1984). Structural inorganic chemistry (5th ed.). Oxford [Oxfordshire] : New York: Clarendon Press ; Oxford University Press. ISBN 0-19-855370-6.
- ^ Evans H.T. (1981). "Copper coordination in low chalcocite and djurleite and other copper-rich sulfides" (PDF). American Mineralogist. 66 (7–8): 807–818.
- ^ Garisto, Dan (2023-08-16). "LK-99 isn't a superconductor — how science sleuths solved the mystery". Nature (in الإنجليزية). 620 (7975): 705–706. Bibcode:2023Natur.620..705G. doi:10.1038/d41586-023-02585-7. PMID 37587284. S2CID 260955242.
- ^ Jain, Prashant K. "Phase transition of copper (I) sulfide and its implication for purported superconductivity of LK-99." arXiv preprint arXiv:2308.05222 (2023).
- ECHA InfoCard ID from Wikidata
- مقالات بالمعرفة بحاجة لذكر رقم الصفحة بالمصدر from July 2025
- Articles with unsourced statements from July 2025
- كل المقالات ذات العبارات غير المسندة
- مقالات ذات عبارات غير مسندة from July 2025
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- جميع الصفحات التي تحتاج تنظيف
- مقالات بالمعرفة تحتاج توضيح from July 2025
- Sulfide minerals
- Sulfides
- Copper(I) compounds
- Non-stoichiometric compounds

