كلوريد الكوبالت الثنائي
| |||
 Structure of anhydrous compound
| |||
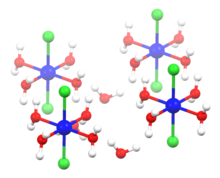 Structure of hexahydrate
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Cobalt(II) chloride
| |||
| أسماء أخرى | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.718 | ||
| رقم EC |
| ||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 3288 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | CoCl2 | ||
| كتلة مولية | 129.839 g/mol (anhydrous) 165.87 g/mol (dihydrate) 237.93 g/mol (hexahydrate) | ||
| المظهر | blue crystals (anhydrous) violet-blue (dihydrate) rose red crystals (hexahydrate) | ||
| الكثافة | 3.356 g/cm3 (anhydrous) 2.477 g/cm3 (dihydrate) 1.924 g/cm3 (hexahydrate) | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 43.6 g/100 mL (0 °C) 45 g/100 mL (7 °C) 52.9 g/100 mL (20 °C) 105 g/100 mL (96 °C) | ||
| قابلية الذوبان | 38.5 g/100 mL (methanol) 8.6 g/100 mL (acetone) soluble in ethanol, pyridine, glycerol | ||
| القابلية المغناطيسية | +12,660·10−6 cm3/mol | ||
| البنية | |||
| البنية البلورية | CdCl2 structure | ||
| هندسة إحداثية |
hexagonal (anhydrous) monoclinic (dihydrate) Octahedral (hexahydrate) | ||
| المخاطر | |||
| صفحة بيانات السلامة | ICSC 0783 | ||
تبويب الاتحاد الاوروپي (DSD)
|
Toxic (T) Carc. Cat. 2 Dangerous for the environment (N) | ||
| توصيف المخاطر | R49, R60, R22, قالب:R42/43, R68, R50/53 | ||
| تحذيرات وقائية | S53, S45, S60, S61 | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | Non-flammable | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
80 mg/kg (rat, oral) | ||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
Cobalt(II) fluoride Cobalt(II) bromide Cobalt(II) iodide | ||
كاتيونات أخرى
|
Rhodium(III) chloride Iridium(III) chloride | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
كلوريد الكوبالت الثنائي مركب كيميائي له الصيغة CoCl2، ويكون على شكل مسحوق بلوري ذي لون أزرق (لامائي) أو زهري (سداسي هيدرات).
الخواص
- بلورات كلوريد الكوبالت الثنائي اللامائية تنحل بشكل جيد في كل من الماء (لون المحلول زهري لتشكل سداسي الهيدرات فوراً)، كما تنحل في الإيثانول.
- الشكل المائي من كلوريد الكوبالت بلوراته لونها زهري، شكلها موشوري، تتسيل بتماسها مع الهواء، تفقد الماء البلوري بدءاً من حوالي 50°س تدريجياً إلى أن تفقده تماماً عند 140°س، وبالتالي يصبح لونه أزرق، وهذه العملية عكسية، إذ أنه عند تعرضه للرطوبة أو بخار الماء سيرتبط مرة أخرى مع جزيئات الماء ليتحول للشكل المائي ذي اللون الزهري.
- تشكل محاليل كلوريد الكوبالت المائية معقد رباعي كلورو الكوبالت بوجود أيونات الكلوريد، ويتحول لون المحلول من الزهري إلى الأزرق، وهذا دليل على تغير في تساند المرتبطات حول الذرة المركزية.
[Co(H2O)6] 2+ + 4Cl- → [Co(Cl)4] 2- + 6H2O
التحضير
يحضر الشكل اللامائي من كلوريد الكوبالت من تمرير غاز الكلور على مسحوق فلز الكوبالت
- Co + Cl2 → CoCl2
الاستخدامات
- نظراً لارتباط التغير اللوني لمركب كلوريد الكوبالت الثنائي بوجود الماء، لذا فإنه يستعمل كمشعر للرطوبة في المجففات.
Safety
In 2005–06, cobalt chloride was the eighth-most-prevalent allergen in patch tests (8.4%).[2]
Other uses
- Invisible ink
- Cobalt chloride is an established chemical inducer of hypoxia-like responses such as erythropoiesis.[3] Cobalt supplementation is not banned and therefore would not be detected by current anti-doping testing.[4] Cobalt chloride is a banned substance under the Australian Thoroughbred Racing
المصادر
- ^ http://www.chemindustry.com/chemicals/0519906.html.
- ^ Zug KA, Warshaw EM, Fowler JF Jr, Maibach HI, Belsito DL, Pratt MD, Sasseville D, Storrs FJ, Taylor JS, Mathias CG, Deleo VA, Rietschel RL, Marks J. Patch-test results of the North American Contact Dermatitis Group 2005–2006. Dermatitis. 2009 May–Jun;20(3):149-60.
- ^ W. Jelkmann: The disparate roles of cobalt in erythropoiesis, and doping relevance. Open Journal of Hematology, 2012, 3–6. http://rossscience.org/ojhmt/2075-907X-3-6.php
- ^ Lippi G, Franchini M, Guidi GC (November 2005). "Cobalt chloride administration in athletes: a new perspective in blood doping?". Br J Sports Med. 39 (11): 872–3. doi:10.1136/bjsm.2005.019232. PMC 1725077. PMID 16244201.
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
This article may include material from Wikimedia licensed under CC BY-SA 4.0. Please comply with the license terms.