هيدريد المغنسيوم
| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Magnesium hydride
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.824 |
| رقم EC |
|
PubChem CID
|
|
| UNII | |
| |
| |
| الخصائص | |
| الصيغة الجزيئية | MgH2 |
| كتلة مولية | 26.3209 g/mol |
| المظهر | بلورات بيضاء |
| الكثافة | 1.45 g/cm3 |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | decomposes |
| قابلية الذوبان | insoluble in ether |
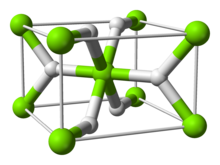
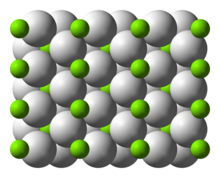
| البنية | |
| البنية البلورية | tetragonal |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−75.2 kJ/mol |
| Standard molar entropy S |
31.1 J/mol K |
| سعة الحرارة النوعية، C | 35.4 J/mol K |
| المخاطر | |
| خطر رئيسي | pyrophoric[1] |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
Beryllium hydride هيدريد الكالسيوم هيدريد السترونشم هيدريد الباريوم |
هيدريدات الماغنسيوم ذات العلاقة
|
أحادي هيدريد الماغنسيوم Mg4H6 |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
هيدريد الماغنسيوم Magnesium hydride هو مركب كيميائي صيغته الجزيئية MgH2. ويحتوي 7.66% وزناً من الهيدروجين وقد دُرِسَ كوسط محتمل لتخزين الهيدروجين.[2]
فعلى سبيل المقارنة، فإن المتر المكعب يحتوي 45 كيلوجرام من الهيدروجين المضغوط على 700 ض.ج.، 70 كيلوجرام من الهيدروجين السائل، أو حتى 106 كيلوجرام من الهيدروجين المربوط في هيدريد المغنسيوم.[3]
كما يُدرَس هيدريد المغنسيوم للاستخدام في القنابل الفراغية والأسلحة الحارقة، منفردة أو كخليط مع مؤكسِد صلب؛ وقد اختبرت الصين "قنبلة هيدروجينية" (غير نووية) باستخدام المادة.[4] كما يمكن أن تستخدم في متفجرات مستحلبة كمصدر للفقاعات ووقود إضافي.[5] كما يمكن إضافته لتحسين إطلاق حرارة مركبات متفجرة ألومينية ولتحسين معدل حرق المواد الدافعة.[6][7]
التحضير
البنية والروابط
التفاعلات
يتفاعل MgH2 فوراً مع الماء منتجاً غاز الهيدروجين:
- MgH2 + 2 H2O → 2 H2 + Mg(OH)2
وعند درجة حرارة 287 °س يتحلل لينتج H2 عند ضغط 1 بار.[8] درجة الحرارة العالية المطلوبة تـُرى كقيد على استخدام MgH2 كوسط تخزين للهيدروجين قابل للعكس:[9]
- MgH2 → Mg + H2
الاستخدامات
قنبلة هيدريد المغنسيوم تخلق لهب مستقر بدرجة حرارة تزيد عن 1000 درجة مئوية، يدوم حوالي 15 مرة أطول من انفجار ثلاثي نيتروتولوين. تخيلوا "شعلة غاز" عملاقة قادرة على إحداث ضرر حراري واسع النطاق - دون تلوث إشعاعي.
يمكن لهذه التقنية المتقدمة أن تُحدث تغييراً جذرياً في التكتيكات العسكرية، مُحوّلةً التركيز من موجة صدمة فورية إلى تأثير حراري طويل الأمد. على الرغم من أنها تُنتج قوة صدمة أقل من ثلاثي نيتروتولوين، إلا أن قدرتها على إذابة سبائك الألومنيوم والتسبب في ضرر حراري واسع النطاق على مساحة واسعة تفتح آفاقًا جديدة في تطوير الأسلحة. يُسلط هذا الإنجاز الضوء على التقدم السريع الذي أحرزته الصين في التكنولوجيا العسكرية، ويُثير نقاشات عالمية حول مستقبل الأسلحة غير النووية عالية الطاقة.[10]
المراجع
- ^ Michalczyk, Michael J (1992). "Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium". Organometallics. 11 (6): 2307–2309. doi:10.1021/om00042a055.
- ^ Bogdanovic, Borislav (1985). "Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides - Applications in Organic Synthesis and Hydrogen Storage". Angewandte Chemie International Edition in English. 24 (4): 262–273. doi:10.1002/anie.198502621.
- ^ https://phys.org/news/2024-01-magnesium-potential-efficient-hydrogen.html
- ^ https://www.msn.com/en-xl/news/other/china-tests-non-nuclear-hydrogen-bomb-science-paper-shows/ar-AA1Dfb1I
- ^ https://patents.google.com/patent/CN102432407B/en
- ^ https://doaj.org/article/4dd9d8e9252b4be794a3e5e233441701
- ^ https://ui.adsabs.harvard.edu/abs/2023DiSus...4...52G/abstract
- ^ McAuliffe, T. R. (1980). Hydrogen and Energy (illustrated ed.). Springer. p. 65. ISBN 978-1-349-02635-7. Extract of page 65
- ^ Schlapbach, Louis; Züttel, Andreas (2001). "Hydrogen-storage materials for mobile applications" (PDF). Nature. 414 (6861): 353–8. Bibcode:2001Natur.414..353S. doi:10.1038/35104634. PMID 11713542. S2CID 3025203.
- ^ Peacemaker على تويتر