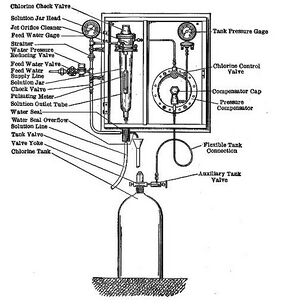
كلورة المياه

كلورة المياه (Water chlorination)، هي عملية إضافة الكلور أو مركبات الكلور مثل هيپوكلوريت الصوديوم إلى المياه. تُستخدم هذه الطريقة للقضاء على الجراثيم والڤيروسات والميكروبات الأخرى في الماء. وتُستخدم الكلورة تحديداً لمنع انتشار الأمراض المنقولة بالمياه مثل الكوليرا والزحار والتيفوئيد.[1][2][3]
التاريخ
في ورقة بحثية نُشرت عام 1894، اقتُرح رسمياً إضافة الكلور إلى الماء لجعله "خالياً من الجراثيم". أيّد خبيران آخران هذا الاقتراح ونشراه في أوراق بحثية أخرى عديدة عام 1895.[4] بُذلت محاولات مبكرة لتطبيق الكلورة في محطات معالجة المياه عام 1893 في هامبورگ بألمانيا. وفي عام 1897، كانت مدينة ميدستون بإنگلترة أول من عولج كامل إمدادات مياهها بالكلور.[5]
بدأت عملية الكلورة الدائمة للمياه عام 1905، عندما تسبب خلل في مرشح الرمل البطيء وإمدادات المياه الملوثة في انتشار وباء التيفوئيد الخطير في لنكن.[6] استخدم ألكسندر كروكشانك هيوستن كلورة المياه لوقف الوباء. غذّت منشأته محلولاً مركزاً مما يُسمى "الجير المكلور" (مزيج من هيپوكلوريت الكالسيوم، وهيدروكسيد الكالسيوم، وكلوريد الكالسيوم) إلى المياه المعالجة. لم يكن هذا مجرد كلوريد الكالسيوم الحديث، بل احتوى على غاز الكلور المذاب في ماء الجير (هيدروكسيد الكالسيوم المخفف) لتكوين هيپوكلوريت الكالسيوم (الجير المكلور). ساعدت كلورة إمدادات المياه في وقف الوباء، وكإجراء احترازي، استمرت حتى عام 1911 عندما تم تشغيل مصدر مياه جديد.[7]
كان أول استخدام مستمر للكلور في الولايات المتحدة للتطهير عام 1908 في خزان بونتون (على نهر روكواي)، والذي كان بمثابة مصدر إمداد جرزي سيتي، نيوجرزي.[8] جرت عملية الكلورة بإضافة محاليل مخففة من كلوريد الجير (هيپوكلوريت الكالسيوم) بجرعات تتراوح بين 0.2 و0.35 جزء في المليون. عملية المعالجة ابتكرها جون ليل، وصمم جورج وارن فولر محطة الكلورة.[9] على مدى السنوات القليلة التالية، كانت عملية التتطهير بالكلور تتم باستخدام كلوريد الجير (هيپوكلوريت الكالسيوم) بسرعة في أنظمة مياه الشرب في جميع أنحاء العالم.[10]
طُوِّرت تقنية تنقية مياه الشرب باستخدام غاز الكلور المسال المضغوط على يد ضابط بريطاني في الخدمة الطبية الهندية، يُدعى ڤنسنت نسفيلد، عام 1903. ووفقاً لروايته، "خطر ببالي أن غاز الكلور قد يكون مُرضياً... إذا وُجدت وسائل مناسبة لاستخدامه... وكان السؤال المهم التالي هو كيفية جعل الغاز قابلاً للنقل. يمكن تحقيق ذلك بطريقتين: تسييله، وتخزينه في أوعية حديدية مبطنة بالرصاص، مزودة بفوهة ذات قناة شعرية دقيقة للغاية، ومُزوَّدة بصنبور أو غطاء لولبي. يُفتح الصنبور، وتُوضع الأسطوانة في الكمية المطلوبة من الماء. يخرج الكلور بفقاعات، وفي غضون عشر إلى خمس عشرة دقيقة يصبح الماء آمناً تماماً. ستكون هذه الطريقة مفيدة على نطاق واسع، كما هو الحال بالنسبة لعربات مياه الخدمة".[11]
أجرى الميجور كارل روجرز دارنال، أستاذ الكيمياء في كلية الطب العسكرية، أول عرض عملي لهذا عام 1910.[12] أصبح هذا العمل أساساً لأنظمة تنقية مياه البلديات الحالية. بعد فترة وجيزة من عرض دارنال، استخدم الجنرال وليام ليستر من الإدارة الطبية للجيش محلولاً من هيپوكلوريت الكالسيوم في كيس من الكتان لمعالجة المياه.[citation needed]
لعقود عديدة، ظلت طريقة ليستر هي المعيار المُتبع للقوات البرية الأمريكية في الميدان والمعسكرات، حيث طُبّقت على شكل حقيبة ليستر المألوفة (وتُكتب أيضاً حقيبة ليستر). كانت هذه الحقيبة القماشية، "الماء، التعقيم"، مكوناً شائعاً في المطابخ الميدانية، حيث تُوزّع على كل 100 شخص، بسعة قياسية تبلغ 36 جالوناً تُعلّق على حامل ثلاثي القوائم غالباً ما يكون مرتجلاً في الميدان. استُبدلت هذه الطريقة، التي استُخدمت من الحرب العالمية الأولى إلى حرب پيتنام، بأنظمة التناضح العكسي التي تُنتج مياه الشرب عن طريق تصفية المياه المحلية بالضغط عبر مرشحات مجهرية: وحدة تنقية المياه بالتناضح العكسي (1980) ونظام تنقية المياه التكتيكي (2007) للإنتاج على نطاق واسع، ووحدة تنقية المياه الخفيفة للاحتياجات الأصغر حجماً، والتي تتضمن تقنية الترشيح الفائق لإنتاج مياه صالحة للشرب من أي مصدر، وتستخدم دورات غسيل عكسي آلية كل 15 دقيقة لتبسيط عمليات التنظيف.[citation needed]
أُستخدم غاز الكلور لأول مرة بشكل مستمر لتطهير إمدادات المياه في مصنع ترشيح بلمونت، فيلادلفيا، پنسلڤانيا باستخدام آلة اخترعها تشارلز فردريك والاس[citation needed] الذي أطلق عليه اسم الكلوريناتور. صُنع بواسطة شركة والاس وتيرنان ابتداء من عام 1913.[13] بحلول عام 1941، حل تطهير مياه الشرب في الولايات المتحدة باستخدام غاز الكلور محل استخدام كلوريد الجير إلى حد كبير.[14][15]
الكيمياء الحيوية
باعتباره هالوجين، يعتبر اكلور مطهر عالي الكفاءة، ويضاف إلى إمدادات المياه العامة لقتل مسببات الأمراض، مثل الجراثيم والڤيروسات ولأوليات، التي تنمو عادة في خزانات إمدادات المياه، وعلى جدران أنابيب المياه الرئيسية وفي خزانات التخزين.[16] كانت العوامل المجهرية المسببة للعديد من الأمراض مثل الكوليرا والتيفوئيد والزحار تقتل عدداً لا يحصى من الأشخاص سنوياً قبل استخدام طرق التطهير بشكل روتيني.[16]
يُصنع معظم الكلور تقريباً من ملح الطعام (كلوريد الصوديوم) عن طريق التحليل الكهربائي في عملية الكلور-القلوي. يُسَلَّط الغاز الناتج عند الضغوط الجوية العالية. ثم يُنقل الغاز المسال ويُستخدم على هذا النحو.[citation needed]
كعامل مؤكسد قوي، يقتل الكلور الأحياء الدقيقة عبر أكسدة الجزيئات العضوية.[16] الكلور وناتج التحلل المائي حمض الهيپوكلوريك غير مشحونين، وبالتالي يخترقان بسهولة سطح مسببات الأمراض المشحون سلباً. وهو قادر على تفكيك الدهون التي تُكوّن جدار الخلية، والتفاعل مع الإنزيمات والپروتينات داخل الخلايا، مما يجعلها غير وظيفية. عندها، تموت الأحياء الدقيقة أو تفقد قدرتها على التكاثر.[17]
المبادئ
عند إذابته في الماء، يتحول الكلور إلى خليط متوازن من الكلور، وحمض الهيپوكلوريك (HOCl)، وحمض الهيدروكلوريك (HCl):
- Cl2 + H2O
 HOCl + HCl
HOCl + HCl
في المحاليل الحمضية، الأنواع الرئيسية هي Cl 2 وHOCl، بينما في المحاليل القلوية، لا يوجد سوى ClO− (أيون الهيپوكلوريت). كما توجد تركيزات صغيرة جداً من ClO−2، ClO−3، ClO−4].[18]
الكلورة الصدمية
تُستخدم عملية الكلورة الصدمية في العديد من المسابح، وآبار المياه، والينابيع، وغيرها من مصادر المياه لتقليل بقايا الجراثيم والطحالب في الماء. تُجرى عملية الكلورة الصدمية بخلط كمية كبيرة من الهيپوكلوريت مع الماء. يمكن أن يكون الهيپوكلوريت على شكل مسحوق أو سائل، مثل مبيض الكلور (محلول هيپوكلوريت الصوديوم أو هيپوكلوريت الكالسيوم في الماء). يجب عدم السباحة في الماء المُكلور بالصدمة أو شربه حتى ينخفض تركيز هيپوكلوريت الصوديوم إلى ثلاثة أجزاء في المليون (ppm) أو حتى ينخفض تركيز هيپوكلوريت الكالسيوم إلى ما بين 0.2 و0.35 جزء في المليون.[citation needed]
كبديل للكلورة الصدمية، تُعالَج بعض المسابح بالكلور باستخدام مرشح مُولِّد للكلور يُحلل كهربائياً الملح الشائع. عادةً ما تحتوي المسابح المُعالَجة بالكلور بهذه الطريقة على مستويات كلور أقل من أحواض السباحة المُعالَجة بالكلور مباشرةً. تُسمى هذه الأحواض بأحواض المياه المالحة.[citation needed]
العيوب
قد يُشكّل التطهير بالكلور مشكلةً في بعض الحالات. إذ يتفاعل الكلور مع المركبات العضوية الطبيعية الموجودة في إمدادات المياه لإنتاج مركبات تُعرف باسم نواتج التطهير الثانوية (DBPs). وأكثر نواتج التطهير الثانوية شيوعاً هي ثلاثي الهالوميثان (THMs) وحمض الهالوأسيتيك (HAAs). يعد ثلاثي الهالوميثان الناتج الثانوي الرئيسي للتطهير الناتج عن الكلورة. عند التعرض لجرعات عالية، يُبطئ البروموفورم نشاط المخ الطبيعي بشكل رئيسي، والذي يتجلى في أعراض مثل النعاس أو التخدير. قد يُسبب التعرض المزمن لكل من البروموفورم وثنائي بروموكلوروميثان سرطان الكبد والكلى، بالإضافة إلى أمراض القلب وفقدان الوعي أو الوفاة عند التعرض لجرعات عالية.[19] نظراً لاحتمالية أن تسبب هذه المركبات السرطان، فإن لوائح مياه الشرب في جميع أنحاء العالم المتقدم تتطلب مراقبة منتظمة لتركيز هذه المركبات في أنظمة توزيع المياه البلدية. وقد ذكرت منظمة الصحة العالمية أن "المخاطر الصحية الناجمة عن هذه المنتجات الثانوية ضئيلة للغاية مقارنةً بالمخاطر المرتبطة بعدم كفاية التطهير".[2]
هناك أيضاً مخاوف أخرى بشأن الكلور، بما في ذلك طبيعته المتطايرة التي تتسبب في اختفائه بسرعة كبيرة من نظام المياه، والمخاوف الحسية مثل الطعم والرائحة.[citation needed]
مزيل الكلور
مزيل الكلور هي مادة كيميائية مضافة تزيل الكلور أو أمين الكلور من الماء. عند إضافة الكلور إلى ماء الصنبور، يجب إزالة الكلور منه قبل استخدامه في حوض السمك، لأن الكلور قد يضر بالحياة المائية بنفس الطريقة التي يقتل بها الأحياء الدقيقة. الكلور يقتل الأسماك،[20] ويسبب أضراراً للمرشح الحيوي للحوض.[21] المواد الكيميائية التي تؤدي هذه الوظيفة هي عوامل الاختزال التي تعمل على اختزال أنواع الكلور إلى كلوريد، وهو غير ضار بالحياة.
بعض المركبات المستخدمة في أجهزة إزالة الكلور التجارية هي ثيوكبريتات الصوديوم، وهيدروكسي ميثان سلفونات الصوديوم، وحمض سلفينيك هيدروكسي ميثان الصوديوم.[citation needed]
انظر أيضاً
- الطرق البديلة لتطهير المياه
- مياه الشرب
- قانون مياه الشرب الآمنة
- Sodium dichloroisocyanurate، المادة الكيميائية الموجودة في أقراص الكلورة
- هيپوكلوريت الصوديوم
- تعقيم (علم الأحياء الدقيقة)
- Trichloroisocyanuric acid، المعروف أيضاً بالسيمكلوسين، المادة الكيميائية الموجودة في أقراص الكلورة
- مرشح المياه
- فلورة المياه
- صناعة المياه
- تلوث المياه
- تنقية المياه
- شبكة توزيع المياه
- معالجة المياه
المصادر
- ^ Matthews, Dylan (2021-11-13). "How a simple solution slashed child mortality in rural Kenyan villages". Vox (in الإنجليزية). Retrieved 2021-11-15.
- ^ أ ب Guidelines for drinking-water quality. WHO Guidelines Approved by the Guidelines Review Committee (4th ed.). World Health Organization. 2022. p. 6. ISBN 978-92-4-004506-4. PMID 35417116.
- ^ "Disinfection with Chlorine | Public Water Systems | Drinking Water | Healthy Water | CDC". www.cdc.gov (in الإنجليزية الأمريكية). 10 October 2018. Retrieved 2020-04-30.
- ^ F.E. Turneaure; and H.L. Russell (1901). Public Water-Supplies: Requirements, Resources, and the Construction of Works (1st ed.). New York: John Wiley & Sons. p. 493.
- ^ "Typhoid Epidemic at Maidstone". Journal of the Sanitary Institute. 18: 388. October 1897.
- ^ "A miracle for public health?". Retrieved 2012-12-17.
- ^ Reece, R.J. (1907). "Report on the Epidemic of Enteric Fever in the City of Lincoln, 1904-5." In Thirty-Fifth Annual Report of the Local Government Board, 1905-6: Supplement Containing the Report of the Medical Officer for 1905-6. London: Local Government Board.
- ^ Leal, John L. (1909). "The Sterilization Plant of the Jersey City Water Supply Company at Boonton, N.J." Proceedings American Water Works Association. pp. 100-9.
- ^ Fuller, George W. (1909). "Description of the Process and Plant of the Jersey City Water Supply Company for the Sterilization of the Water of the Boonton Reservoir." Proceedings AWWA. pp. 110-34.
- ^ Hazen, Allen. (1916). Clean Water and How to Get It. New York: Wiley. p. 102.
- ^ V. B. Nesfield (1902). "A Chemical Method of Sterilizing Water Without Affecting Potability". Public Health. 15: 601–3. doi:10.1016/s0033-3506(02)80142-1.
- ^ Darnall CR (November 1911). "The purification of water by anhydrous chlorine". Am J Public Health. 1 (11): 783–97. doi:10.2105/ajph.1.11.783. PMC 2218881. PMID 19599675.
- ^ "Wallace & Tiernan Corporation Incorporated Corporate Materials" (PDF). Retrieved 2023-11-07.
- ^ Hodges, L. (1977). Environmental Pollution (2nd ed.). New York: Rinehart and Winston. p. 189.
- ^ Baker, Moses N. (1981). The Quest for Pure Water: the History of Water Purification from the Earliest Records to the Twentieth Century. 2nd Edition. Vol. 1. Denver: American Water Works Association. p. 341-342.
- ^ أ ب ت Calderon, R. L. (2000). "The Epidemiology of Chemical Contaminants of Drinking Water". Food and Chemical Toxicology. 38 (1 Suppl): S13–S20. doi:10.1016/S0278-6915(99)00133-7. PMID 10717366.
- ^ Kleijnen, R.G. (16 December 2011). The Chlorine Dilemma (PDF). Eindhoven University of Technology. Archived from the original (PDF) on 2014-02-22. Retrieved 18 January 2014.[صفحة مطلوبة]
- ^ Shunji Nakagawara; Takeshi Goto; Masayuki Nara; Youichi Ozaqa; Kunimoto Hotta; Yoji Arata (1998). "Spectroscopic Characterization and the pH Dependence of Bactericidal Activity of the Aqueous Chlorine Solution". Analytical Sciences. 14 (4): 691–698. doi:10.2116/analsci.14.691.
- ^ Public Health Statement: Bromoform & Dibromochloromethane, ATSDR, 2011[استشهاد ناقص]
- ^ Hargrove, Maddy; Hargrove, Mic (2006). Freshwater Aquariums for Dummies. Hoboken, New Jersey: Wiley Publishing, Inc. p. 181. ISBN 9780470051030.
- ^ Seyffarth, Keith. "Dechlorination - The First Tank Guide - Preparing Your Tap Water for Aquarium Use". First Tank Guide. Archived from the original on 16 February 2017. Retrieved 2017-02-15.
وصلات خارجية
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- مقالات بالمعرفة بحاجة لذكر رقم الصفحة بالمصدر from January 2014
- Articles with incomplete citations from July 2013
- All articles with incomplete citations
- Short description is different from Wikidata
- Articles with unsourced statements from September 2023
- Articles with unsourced statements from March 2015
- Articles with unsourced statements from June 2016
- Articles with unsourced statements from August 2023
- معالجة المياه
- كلور
- اختراعات اسكتلندية
- الصرف الصحي