سترات الكالسيوم
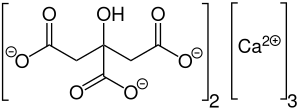 2D structure of calcium citrate
| |
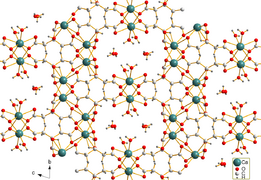 Calcium citrate tetrahydrate[1]
| |
 Calcium citrate tetrahydrate
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
2-hydroxy-1,2,3-propane-tricarboxylic acid calcium salt (2:3)
| |
| أسماء أخرى
E333, tricalcium dicitrate
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.011.265 |
| رقم EC |
|
| E number | E333 (antioxidants, ...) |
PubChem CID
|
|
| UNII |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Ca3(C6H5O7)2 |
| كتلة مولية | 498.4334 g/mol (anhydrous) 570.4945 g/mol (tetrahydrate) |
| المظهر | White powder |
| الرائحة | odorless |
| الكثافة | 1.63 g/cm3 (anhydrous) 2.00 g/cm3 (tetrahydrate)[1] |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 0.85 g/L (18 °C) 0.95 g/L (25 °C) |
| قابلية الذوبان | insoluble in alcohol |
| البنية | |
| البنية البلورية | Triclinic (tetrahydrate) |
| الزمرة الفراغية | P1, No. 2 |
| ثابت العقد | a = 0.59466(4) nm, b = 1.02247(8) nm, c = 1.66496(13) nm |
| ثابت العقد | α = 72.213(7)°, β = 79.718(7)°, γ = 89.791(6)° |
| المخاطر | |
| خطر رئيسي | Irritant |
| NFPA 704 (معيـَّن النار) | |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
Magnesium citrate Strontium citrate |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
سترات الكالسيوم مركب كيميائي له الصيغة Ca3(C6H5O7)2 ، ويكون على شكل بلورات بيضاء، وهو ملح الكالسيوم لحمض الليمون (حمض الستريك). It is commonly used as a food additive (E333), usually as a preservative, but sometimes for flavor. In this sense, it is similar to sodium citrate. Calcium citrate is also found in some dietary calcium supplements (e.g. Citracal or Caltrate). Calcium makes up 24.1% of calcium citrate (anhydrous) and 21.1% of calcium citrate (tetrahydrate) by mass. The tetrahydrate occurs in nature as the mineral Earlandite.
الخواص
- لمركب سترات الكالسيوم انحلالية ضعيفة في الماء، فقط 0.95 غ/ل عند 25°س. يختلف سترات الكالسيوم عن باقي أغلب الأملاح بأن انحلاليته تزداد بانخفاض درجة الحرارة (انحلالية عكسية). تزداد الانحلالية أيضاً بارتفاع pH الوسط. بالمقابل فإن لا ينحل في الكحول مثل الإيثانول.[1]
- يبلغ محتوى الكالسيوم في هذا المركب 21% من الشكل الخالي من الماء، حيث أن سترات الكالسيوم يوجد أيضاً على شكل هيدرات (رباعي هيدرات)، ويبدأ بفقدان ماء التبلور عند التسخين فوق 120°س.
الانتاج
Calcium citrate is an intermediate in the isolation of citric acid from the fungal fermentation process by which citric acid is produced industrially.[2] The citric acid in the broth solution is neutralized by limewater, precipitating insoluble calcium citrate. This is then filtered off from the rest of the broth and washed to give clean calcium citrate.
- 3 Ca(OH)2(s) + 2 C6H8O7(l) → Ca3(C6H5O7)2(s) + 6 H2O(l)
The calcium citrate thus produced may be sold as-is, or it may be converted to citric acid using dilute sulfuric acid.
التحضير
يحضر سترات الكالسيوم (رباعي هيدرات) من تفاعل تعديل حمض الليمون (حمض الستريك) بهيدروكسيد الكالسيوم، وهو تفاعل ناشر للحرارة:
3Ca(OH)2 + 2C6H8O7 → Ca3(C6H5O7)2 + 6H2O
يحصل على سترات الكالسيوم طبيعياً كمركب وسيط أثناء عزل حمض الستريك من عمليات التخمير في عمليات تحضير حمض الستريك صناعياً. [3]
الاستخدامات
- يستعمل سترات الكالسيوم في الصناعات الغذائية كمضاف غذائي، حيث يستعمل كمادة حافظة. للمركب رقم الإي E 333.
- له تطبيقات في مجال إزالة قساوة المياه.
- يستخدم لتحضير أملاح السترات الأخرى، ويدخل في تركيب بعض المستحضرات الطبية المستخدمة لإغناء محتوى الكالسيوم، على سبيل المثال معاجين الأسنان.
Bioavailability
In many individuals, bioavailability of calcium citrate is found to be equal to that of the cheaper calcium carbonate (CaCO3).[4] However, alterations to the digestive tract may change how calcium is digested and absorbed. Unlike calcium carbonate, which is basic and neutralizes stomach acid, calcium citrate has no effect on stomach acid.[5][مطلوب مصدر أفضل] Calcium carbonate is harder to digest than calcium citrate,[5] and calcium carbonate carries a risk of "acid rebound" (the stomach overcompensates by producing more acid),[5] so individuals who are sensitive to antacids or who have difficulty producing adequate stomach acid may choose calcium citrate over calcium carbonate for supplementation.
According to a 2009 research into calcium absorption after gastric bypass surgery,[6] calcium citrate may have improved bioavailability over calcium carbonate in Roux-en-Y gastric bypass patients who are taking calcium citrate as a dietary supplement after surgery. This is mainly due to the changes related to where calcium absorption occurs in the digestive tract of these individuals.
انظر أيضاً
المصادر
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
المراجع
- ^ أ ب ت Herdtweck E, Kornprobst T, Sieber R, Straver L, Plank J (2011). "Crystal Structure, Synthesis, and Properties of tri-Calcium di-Citrate tetra-Hydrate [Ca3(C6H5O7)2(H2O)2]·2H2O". Zeitschrift für anorganische und allgemeine Chemie. 637 (6): 655–659. doi:10.1002/zaac.201100088.
- ^ "Use of Lime in the Chemical Industry". National Lime Association. Archived from the original on 2006-09-29. Retrieved 2006-11-25.
- ^ "Use of Lime in the Chemical Industry". National Lime Association. Retrieved 2006-11-25.
- ^ Heaney RP, Dowell MS, Bierman J, Hale CA, Bendich A (2001). "Absorbability and cost-effectiveness in calcium supplementation". Journal of the American College of Nutrition. 20 (3): 239–46. doi:10.1080/07315724.2001.10719038. PMID 11444420. S2CID 206488.
- ^ أ ب ت "What you need to know about calcium". Harvard Health Publications. 9 June 2009. Retrieved 4 August 2014.
- ^ Tondapu P, Provost D, Adams-Huet B, Sims T, Chang C, Sakhaee K (June 2009). "Comparison of the Absorption of Calcium Carbonate and Calcium Citrate after Roux-en-Y Gastric Bypass". Obesity Surgery. 19 (9): 1256–1261. doi:10.1007/s11695-009-9850-6. PMC 4469176. PMID 19437082.
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Chemical articles with unknown parameter in Chembox
- Short description is different from Wikidata
- كل المقالات بدون مراجع موثوقة
- كل المقالات بدون مراجع موثوقة from May 2023
- سترات
- مركبات الكالسيوم
- مضافات غذائية بأرقام أوروپية
