بيروكسيد الهيدروجين
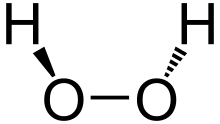
| |||
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Hydrogen peroxide
| |||
| اسم أيوپاك النظامي
Peroxol Dioxidane | |||
| أسماء أخرى
Oxidanyl
Perhydroxic acid 0-hydroxyol Oxygenated water Peroxaan | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.878 | ||
| رقم EC |
| ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 2015 (>60% soln.) 2014 (20–60% soln.) 2984 (8–20% soln.) | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | H2O2 | ||
| كتلة مولية | 34 g mol-1 | ||
| المظهر | Very light blue liquid | ||
| الرائحة | slightly sharp | ||
| الكثافة | 1.11 g/cm3 (20 °C, 30% (w/w) solution)[1] 1.450 g/cm3 (20 °C, pure) | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | Miscible | ||
| قابلية الذوبان | soluble in ether, alcohol insoluble in petroleum ether | ||
| log P | −0.43[2] | ||
| ضغط البخار | 5 mmHg (30 °C)[3] | ||
| الحموضة (pKa) | 11.75 | ||
| القابلية المغناطيسية | −17.7·10−6 cm3/mol | ||
| معامل الانكسار (nD) | 1.4061 | ||
| اللزوجة | 1.245 cP (20 °C) | ||
| Dipole moment | 2.26 D | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−187.80 kJ/mol | ||
| سعة الحرارة النوعية، C | 1.267 J/(g·K) (gas) 2.619 J/(g·K) (liquid) | ||
| علم الأدوية | |||
| A01AB02 (WHO) D08AX01, D11AX25, S02AA06 | |||
| المخاطر | |||
| صفحة بيانات السلامة | ICSC 0164 (>60% soln.) | ||
| ن.م.ع. مخطط تصويري |   
| ||
| ن.م.ع. كلمة الاشارة | danger | ||
| H271, H302, H314, H332, H335, H412 | |||
| P280, P305+P351+P338, P310 | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | Non-flammable | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
1518 mg/kg[citation needed] 2000 mg/kg (oral, mouse)[4] | ||
LC50 (التركيز الأوسط)
|
1418 ppm (rat, 4 hr)[4] | ||
LCLo (المنشورة الأقل)
|
227 ppm (mouse)[4] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 1 ppm (1.4 mg/m3)[3] | ||
REL (الموصى به)
|
TWA 1 ppm (1.4 mg/m3)[3] | ||
IDLH (خطر عاجل)
|
75 ppm[3] | ||
| مركبات ذا علاقة | |||
مركـّبات ذات علاقة
|
Water Ozone Hydrazine Hydrogen disulfide Dioxygen difluoride | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
فوق أكسيد الهيدروجين إنگليزية: Hydrogen peroxide أو (پيروكسيد الهيدروجين أو الماء الأكسجيني) مركب كيميائي له الصيغة (H2O2)، وهو ذو لون أزرق باهت والذي يبدو عديم اللون في المحاليل الممدة، وهو بشكل طفيف أكثر لزوجة من الماء. يعد فوق أكسيد الهيدروجين حمضاً ضعيفاً، إلا أنه من المواد المبيضة الجيدة نظراً لخواصه المؤكسدة القوية.
يمكن تفكيك فوق أكسيد الهيدروجين للحصول على الماء والأكسجين بوضع عامل المساعد هو ثاني أكسيد المنجنيز ويعطي أكسجين نقي.
الخصائص
The boiling point of H
2O
2 has been extrapolated as being 150.2 °C (302.4 °F), approximately 50 °C (90 °F) higher than water. In practice, hydrogen peroxide will undergo potentially explosive thermal decomposition if heated to this temperature. It may be safely distilled at lower temperatures under reduced pressure.[5]
Hydrogen peroxide forms stable adducts with urea (hydrogen peroxide–urea), sodium carbonate (sodium percarbonate) and other compounds.[6] An acid-base adduct with triphenylphosphine oxide is a useful "carrier" for H
2O
2 in some reactions.
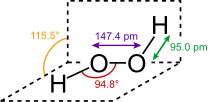
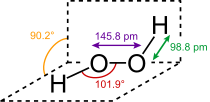
البنية
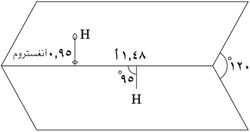
يتخذ H2O2 بنية غير مستوية بتماثل C2. وبالرغم من أنه متماكب ضوئياً، فإن الجزيء يتعرض لروسمة سريعة. فالشكل المفلطح للمتشاكل anti سيقلل الإعاقة الفراغية، وزاوية الإلتواء 90° للمتشاكل syn سوف تصل لأفضل خلط بين المداري p-type المملوء للأكسجين (أحد الأزواج الوحيدة) وأشغر المدارات الجزيئية للرابطة O-H المجاورة.[7] الشكل ذو الميل المعاكس "الملتوي" الملاحـَظ هو توفيق بين متشاكلين اثنين.
يأخذ فوق أكسيد الهدروجين استناداً إلى قياسات الأشعة السينية البنية الجزيئية المبيّنة:
إن طاقة الرابطة O−O ت (200كيلو جول/مول) أصغر تقريباً بمرتين من طاقة الرابطة H−O ك (468كيلوجول/مول) وبسبب توزع الروابِط H−O غير المتناظر يعد الجزيء H2O2 قطبياً بصورة شديدة.
أما طول الرابطة O−O فيساوي 1.48 أنغستروم والرابطة H−O تساوي 0.95 أنغستروم والزاوية O−Ô−O تساوي 95 ْوتقع الرابطتان O−H في مستويين يصنعان زاوية تساوي120 ْ.
الخصائص الفيزيائية
سائل شفاف لا رائحة له ولا لون، درجة انصهاره -43 ْس يمكن إعادة تبريده بسهولة من دون تجمد، درجة غليانه 150 ْس. يمكن مزجه مع الماء بنسب مختلفة، ويمكنه تشكيل بلورات هيدراتية H2O2,2H2O وهو مثل الماء يُذيب الأملاح جيداً.
الماء الأكسجيني النقي ثابت بصورة كافية ،وبوجود المعادن الثقيلة أو أيوناتها (شواردها) أو الوسطاء الفعالة للتحطيم مثل أملاح أو معقدات أو مركبات الحديد والنحاس والمنجنيز أو القلويات يتفكك إلى H2O وO2 ناشراً الحرارة وربما يتفكك مع انفجار.
يُحفظ الماء الأكسجيني في أوعية من الألمنيوم النقي، ويضاف إليه عادة بيروفوسفات الصوديوم Na4P2O7 أو قصديريت الصوديوم أو الأسيت أنيليد مثبِّتاً. المحاليل المائية للماء الأكسجيني أثبت من فوق أكسيد الهدروجين النقي ويمكن حفظها فترة طويلة.
الخصائص الكيمياوية
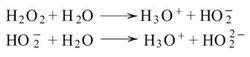
تظهر الخواص الكيمياوية للماء الأكسجيني بفعله المؤكسد وفعله المُرجِع وبصفاته الحمضية وبدخوله في تشكيل مركبات معقدة. فمثلاً يظهر فعله المؤكسِد في مختلف الأوساط مشكلاً الماء. فمع أيونات اليوديد في وسط حمضي، على سبيل المثال، يتكوّن اليود الحر وكبريتات البوتاسيوم والماء:
ومع أيونات الكروم الثلاثي في وسط قلوي يتكوَّن أيون الكرومات الصفراء اللون:
ومع كبريتيد الرصاص الأسود يتكوَّن كبريتات الرصاص ذات اللون الأبيض والماء:
وهو يؤكسد أيونات الحديد الثنائي في وسط حمضي إلى أيونات الحديد الثلاثي ويتشكل الماء:
كما يؤكسد أيون النتريت إلى أيون النترات ، وأيون الزرنيخيت إلى أيون الزرنيخات.
إن آلية أكسدة المركبات المختلفة بفوق أكسيد الهدروجين هي آلية صعبة، وفي أثناء التفاعلات يتشكل مركبات وسطية مثل OH وHO2 تتصف بخواص مؤكسدة أقوى من فوق أكسيد الهدروجين؛ ومثال هذا تفاعل فوق أكسيد الهدروجين مع أيون الحديد الثنائي التكافؤ:
وهذا المزيج المؤلف من محاليل H2O2 وأملاح الحديد Fe2+ المعروف بكاشف فينتون يستعمل لأكسدة المركبات العضوية المختلفة.
أما فعله المرجِع فيظهر في تأكسد أيون فوق الأكسيد
وتحوله إلى O2:
ففي المحاليل الأساسية يرجع أيون الحديد الثلاثي إلى أيون الحديد الثنائي:
ويرجِع [[أكسيدَ الفضة Ag2O مطلقاً الأكسجين والفضة المعدنية:
ويرجِع في الوسط الحمضي كثيراً من المواد المؤكسِدة مثل الكلور وماء الكلور وبرمنجنات البوتاسيوم وثنائي كرومات البوتاسيوم:
فمع ماء الكلور يتم إرجاع Cl (l) إلى Cl(-l)
ومع برمنجنات البوتاسيوم يتحول المنجنيز سباعي التكافؤ إلى ثنائي التكافؤ:
يستعمل هذا التفاعل للتحديد الكمي لفوق أكسيد الهدروجين في المحلول.
ومع ثاني كرومات البوتاسيوم البرتقالي اللون يتم إرجاع الكروم السداسي التكافؤ إلى الكروم الثلاثي التكافؤ ذي اللون الأخضر:
ويسلك الماء الأكسجيني في المحلول سلوك حمض ثنائي الوظيفة الحمضية وهو حمض ضعيف يتأين (يتشرد) في المحاليل المائية على مرحلتين وهو أكثر حموضة من الماء:
وهو- شأنه شأن الحموض - يغير لون عباد الشمس من الأزرق إلى الأحمر، في حين محاليله الممددة لا تؤثر في المشعرات.
يتفاعل الماء الأكسجيني مع القلويات مكوناً أملاحاً لهذا الحمض مثل Na2O2،BaO2 :
ويؤثر في أملاح الكربونات وينطلق غاز CO2
ويطلق على المركبات Na2O2 و BaO2 أي الأكاسيد التي تحوي الأيون (الشــاردة)
اسـم فوق أكاسـيد. وهي ذات بنية بلورية أيونية، أيوناتها الموجبة هي الأيونات المعدنية، وأيوناتها السالبة هي
وهي تعرف خاصة للمعادن القلوية M2O2 باستثناء الليتيوم، وللمعادن القلوية الترابية MO2. وعندما تتفاعل فوق الأكاسيد مع الماء يتكون هدروكسيد المعدن وماء أكسجيني. وأهم فوق الأكاسيد، عملياً، فوق أكسيد الصوديوم Na2O2 إذ يستعمل في المختبر لتحضير الأكسجين (يعرف لذلك بالحجر الأكسجيني) وفي صناعة المواد المنظفة، كما يستعمل لتخليص الهواء من غاز الكربون وتوليد الأكسجين وفقاً للتفاعل:
يستطيع الجذر
الدخول أيضاً في الحموض مكوِّناً فوق الحموض مثل فوق حمض الكبريت H2SO5 (حمض كارو)، وفوق حمض الكربون H2CO4 وفوق حمض الآزوت HNO4. ويدخل في الأسس مكوِّناً مثلاً NaOOH الذي يدعى بهيدرو فوق أكسيد الصوديوم.
أما الكشف النوعي عن الماء الأكسجيني فيظهر في تأثيره في ثاني كرومات البوتاسيوم في وسط حمضي بوجود ثنائي إيتيل الإيتر حيث تتكون طبقة الإيتر بلون فوق أكسيد الكروم CrO5 الأزرق السماوي والذي يتفكك بتماسه مع حمض الكبريت مشكلاً في الطبقة المائية الكروم الثلاثي ذا اللون الأخضر وفق ما يأتي:
الجزيء H2O2 مثل جزيء الماء H2O مانح ثنائيات إلكترونية حرة إذ يستطيع الدخول في المعقدات فهو مرتبط معتدل مثلاً في الأيون المعقد [Fe (H2O)5(H2O2)]3+ وكذلك يستطيع تشكيل مركبات بلورية مشابهة للهيدرات وتدعى بـ بيرأوكسوهيدرات مثل:CaO2.2H2O2 ¨ K2CO3. 3H2O2 .[8]
Aqueous solutions
In aqueous solutions, hydrogen peroxide forms a eutectic mixture, exhibiting freezing-point depression down as low as −56 °C; pure water has a freezing point of 0 °C and pure hydrogen peroxide of −0.43 °C. The boiling point of the same mixtures is also depressed in relation with the mean of both boiling points (125.1 °C). It occurs at 114 °C. This boiling point is 14 °C greater than that of pure water and 36.2 °C less than that of pure hydrogen peroxide.[9]

2O
2 and water: Area above blue line is liquid. Dotted lines separate solid–liquid phases from solid–solid phases.
| H 2O 2 (w/w) |
Density (g/cm3) |
Temp. (°C) |
|---|---|---|
| 3% | 1.0095 | 15 |
| 27% | 1.10 | 20 |
| 35% | 1.13 | 20 |
| 50% | 1.20 | 20 |
| 70% | 1.29 | 20 |
| 75% | 1.33 | 20 |
| 96% | 1.42 | 20 |
| 98% | 1.43 | 20 |
| 100% | 1.45 | 20 |
Hydrogen peroxide is most commonly available as a solution in water. For consumers, it is usually available from pharmacies at 3 and 6 wt% concentrations. The concentrations are sometimes described in terms of the volume of oxygen gas generated; one milliliter of a 20-volume solution generates twenty milliliters of oxygen gas when completely decomposed. For laboratory use, 30 wt% solutions are most common. Commercial grades from 70% to 98% are also available, but due to the potential of solutions of more than 68% hydrogen peroxide to be converted entirely to steam and oxygen (with the temperature of the steam increasing as the concentration increases above 68%) these grades are potentially far more hazardous and require special care in dedicated storage areas. Buyers must typically allow inspection by commercial manufacturers.
Comparison with analogues
Hydrogen peroxide has several structural analogues with H
mX−XH
n bonding arrangements (water also shown for comparison). It has the highest (theoretical) boiling point of this series (X = O, S, N, P). Its melting point is also fairly high, being comparable to that of hydrazine and water, with only hydroxylamine crystallising significantly more readily, indicative of particularly strong hydrogen bonding. Diphosphane and hydrogen disulfide exhibit only weak hydrogen bonding and have little chemical similarity to hydrogen peroxide. Structurally, the analogues all adopt similar skewed structures, due to repulsion between adjacent lone pairs.
| Name | Formula | Molar mass (g/mol) |
Melting point (°C) |
Boiling point (°C) |
|---|---|---|---|---|
| Water | HOH | 18.02 | 0.00 | 99.98 |
| Hydrogen peroxide | HOOH | 34.01 | −0.43 | 150.2* |
| Hydrogen disulfide | HSSH | 66.15 | −89.6 | 70.7 |
| Hydrazine | H2NNH2 | 32.05 | 2 | 114 |
| Hydroxylamine | NH2OH | 33.03 | 33 | 58* |
| Diphosphane | H2PPH2 | 65.98 | −99 | 63.5* |
الاكتشاف
قام بعزل پروكسيد الهيدروجين لأول مرة في 1818 لوي جاك ثينار بتفاعل پروكسيد الباريوم مع حمض النيتريك.[10]
Alexander von Humboldt is sometimes said to have been the first to report the first synthetic peroxide, barium peroxide, in 1799 as a by-product of his attempts to decompose air, although this is disputed due to von Humboldt's ambiguous wording.[11] Nineteen years later Louis Jacques Thénard recognized that this compound could be used for the preparation of a previously unknown compound, which he described as eau oxygénée ("oxygenated water") — subsequently known as hydrogen peroxide.[12][13][14]
An improved version of Thénard's process used hydrochloric acid, followed by addition of sulfuric acid to precipitate the barium sulfate byproduct. This process was used from the end of the 19th century until the middle of the 20th century.[15]
The bleaching effect of peroxides and their salts on natural dyes had been known since Thénard's experiments in the 1820s, but early attempts of industrial production of peroxides failed. The first plant producing hydrogen peroxide was built in 1873 in Berlin. The discovery of the synthesis of hydrogen peroxide by electrolysis with sulfuric acid introduced the more efficient electrochemical method. It was first commercialized in 1908 in Weißenstein, Carinthia, Austria. The anthraquinone process, which is still used, was developed during the 1930s by the German chemical manufacturer IG Farben in Ludwigshafen. The increased demand and improvements in the synthesis methods resulted in the rise of the annual production of hydrogen peroxide from 35,000 tonnes in 1950, to over 100,000 tonnes in 1960, to 300,000 tonnes by 1970; by 1998 it reached 2.7 million tonnes.[16]
Early attempts failed to produce neat hydrogen peroxide. Anhydrous hydrogen peroxide was first obtained by vacuum distillation.[17]
Determination of the molecular structure of hydrogen peroxide proved to be very difficult. In 1892, the Italian physical chemist Giacomo Carrara (1864–1925) determined its molecular mass by freezing-point depression, which confirmed that its molecular formula is H
2O
2.[18] H
2O=O seemed to be just as possible as the modern structure, and as late as in the middle of the 20th century at least half a dozen hypothetical isomeric variants of two main options seemed to be consistent with the available evidence.[19] In 1934, the English mathematical physicist William Penney and the Scottish physicist Gordon Sutherland proposed a molecular structure for hydrogen peroxide that was very similar to the presently accepted one.[20][21]
الانتاج
In 1994, world production of H
2O
2 was around 1.9 million tonnes and grew to 2.2 million in 2006,[22] most of which was at a concentration of 70% or less. In that year, bulk 30% H
2O
2 sold for around 0.54 USD/kg, equivalent to US$1.50/kg (US$0.68/lb) on a "100% basis".[23][مطلوب توضيح]
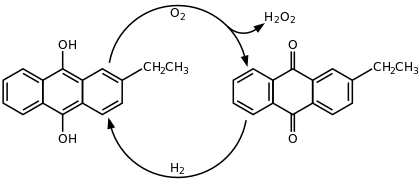
Today, hydrogen peroxide is manufactured almost exclusively by the anthraquinone process, which was originally developed by BASF in 1939. It begins with the reduction of an anthraquinone (such as 2-ethylanthraquinone or the 2-amyl derivative) to the corresponding anthrahydroquinone, typically by hydrogenation on a palladium catalyst. In the presence of oxygen, the anthrahydroquinone then undergoes autoxidation: the labile hydrogen atoms of the hydroxy groups transfer to the oxygen molecule, to give hydrogen peroxide and regenerating the anthraquinone. Most commercial processes achieve oxidation by bubbling compressed air through a solution of the anthrahydroquinone, with the hydrogen peroxide then extracted from the solution and the anthraquinone recycled back for successive cycles of hydrogenation and oxidation.[23][24]
The net reaction for the anthraquinone-catalyzed process is:[23]
- H
2 + O
2 → H
2O
2
The economics of the process depend heavily on effective recycling of the extraction solvents, the hydrogenation catalyst and the expensive quinone.
طرق تاريخية
Hydrogen peroxide was once prepared industrially by hydrolysis of ammonium persulfate:
- [NH
4]
2S
2O
8 + 2 H
2O → 2 [NH
4]HSO
4 + H
2O
2
[NH
4]
2S
2O
8 was itself obtained by the electrolysis of a solution of ammonium bisulfate ([NH
4]HSO
4) in sulfuric acid.[25]
سبل أخرى
Small amounts are formed by electrolysis, photochemistry, electric arc, and related methods.[26]
A commercially viable route for hydrogen peroxide via the reaction of hydrogen with oxygen favours production of water but can be stopped at the peroxide stage.[27][28] One economic obstacle has been that direct processes give a dilute solution uneconomic for transportation. None of these has yet reached a point where it can be used for industrial-scale synthesis.
يحضر الماء الأكسجيني مخبرياً على البارد بتأثير الحموض الممدة في فوق أكسيد المعادن BaO2 أو Na2O2، ويحضر بسهولة من تفاعل حمض الكبريت الممدد مع فوق أكسيد الباريوم ويتكوَّن راسب كبريتات الباريوم.
وبترشيح الراسب المتشكل يحصل على محلول ممدد من H2O2 بتركيز قدره 5%.
أما صناعياً فيحضر بطرائق عديدة منها:
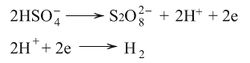
ـ التحليل الكهربائي لكبريتات الأمونيوم الحامضية NH4HSO4 أو حمض الكبريت باستعمال كثافة تيار عالية ومسـريين من البـلاتين فيتأكسد الأيون
على المصعد متحولاً إلى أيون بِرأوكسو ثنائي الكبريتات وينطلق الهدروجين على المهبط وفق التفاعل:
وبحلمهة الأيون أو حمضها الناتج يحصل على محلول مخفف من الماء الأكسجيني تركيزه 30%:
ـ بأكسدة الكحول الإيزوبروبيلي.
وبالتقطير يتخلص من الأسيتون
وفي الطبيعة يتشكل الماء الأكسجيني كنواتج فاصلة أو مشابهة خلال أكسدة المركبات المعدنية بأكسجين الهواء، ويتشكل في الخلايا النباتية والحيوانية بتركيز ضعيف جداً، لأنه يتفكك بتأثير الخمائر الوسيطية مؤكسداً مركباتها العضوية.
التفاعلات
الانحلال
ينحل بروكسيد الهيدروجين، ناشراً للحرارة (بشكل غير متناسب)، إلى ماء وغاز الأكسجين آنياً:
- 2 H2O2 → 2 H2O + O2
هذه العملية مُفضـَّلة ثرموديناميكياً. فلها ΔHo of −98.2 kJ·mol−1 and a ΔGo of −119.2 kJ·mol−1 and a ΔS of 70.5 J·mol−1·K−1. معدل الانحلال يعتمد على درجة الحرارة وتركيز الپروكسيد، وكذلك pH ووجود شوائب ومثبتتات.
تفاعلات أكسدة-اختزال
في محلول حمضي، فإن H2O2 هو أحد أقوى المؤكسِدات المعروفة—أقوى من الكلور, ثاني أكسيد الكلور وپرمنگنات الپوتاسيوم. وكذلك عبر التحفيز، فإن H2O2 يمكن تحويله إلى hydroxyl radicals (.OH)، التي هي عالية التفاعل.
| المؤكسِد | القدرة على الأكسدة، V |
|---|---|
| فلور | 3.0 |
| جذر هيدروكسيل | 2.8 |
| اوزون | 2.1 |
| پروكسيد الهيدروجين | 1.8 |
| پرمنگنات الپوتاسيوم | 1.7 |
| ثاني أكسيد الكلور | 1.5 |
| كلور | 1.4 |
القلوية
الكيمياء الحيوية
Production
The aerobic oxidation of glucose in the presence of the enzyme glucose oxidase produces hydrogen peroxide. The conversion affords gluconolactone:[29]
- C
6H
12O
6 + O
2 → C
6H
10O
6 + H
2O
2
Superoxide dismutases (SOD)s are enzymes that promote the disproportionation of superoxide into oxygen and hydrogen peroxide.[30]
- 2 O−
2 + 2 H+
→ O
2 + H
2O
2 - 2 H
2O
2 → O
2 + 2 H
2O
Peroxisomes are organelles found in virtually all eukaryotic cells.[31] They are involved in the catabolism of very long chain fatty acids, branched chain fatty acids, D-amino acids, polyamines, and biosynthesis of plasmalogens and ether phospholipids, which are found in mammalian brains and lungs.[32] They produce hydrogen peroxide in a process catalyzed by flavin adenine dinucleotide (FAD):[33]
- R-CH
2-CH
2-CO-SCoA + O
2 R-CH=CH-CO-SCoA + H
2O
2
Hydrogen peroxide arises by the degradation of adenosine monophosphate, which yields hypoxanthine. Hypoxanthine is then oxidatively catabolized first to xanthine and then to uric acid, and the reaction is catalyzed by the enzyme xanthine oxidase:[34]
The degradation of guanosine monophosphate yields xanthine as an intermediate product which is then converted in the same way to uric acid with the formation of hydrogen peroxide.[34]
Consumption
Catalase, another peroxisomal enzyme, uses this H
2O
2 to oxidize other substrates, including phenols, formic acid, formaldehyde, and alcohol, by means of a peroxidation reaction:
- H
2O
2 + R'H
2 → R' + 2 H
2O
thus eliminating the poisonous hydrogen peroxide in the process.
This reaction is important in liver and kidney cells, where the peroxisomes neutralize various toxic substances that enter the blood. Some of the ethanol humans drink is oxidized to acetaldehyde in this way.[35] In addition, when excess H
2O
2 accumulates in the cell, catalase converts it to H
2O through this reaction:
- H
2O
2 → 0.5 O
2 + H
2O
Glutathione peroxidase, a selenoenzyme, also catalyzes the disproportionation of hydrogen peroxide.
Fenton reaction
The reaction of Fe2+ and hydrogen peroxide is the basis of the Fenton reaction, which generates hydroxyl radicals, which are of significance in biology:
- Fe(II) + H
2O
2 → Fe(III)OH + HO·
The Fenton reaction explains the toxicity of hydrogen peroxides because the hydroxyl radicals rapidly and irreversibly oxidize all organic compounds, including proteins, membrane lipids, and DNA.[36] Hydrogen peroxide is a significant source of oxidative DNA damage in living cells. DNA damage includes formation of 8-Oxo-2'-deoxyguanosine among many other altered bases, as well as strand breaks, inter-strand crosslinks, and deoxyribose damage.[37] By interacting with Cl−, hydrogen peroxide also leads to chlorinated DNA bases.[37] Hydroxyl radicals readily damage vital cellular components, especially those of the mitochondria.[38][39][40] The compound is a major factor implicated in the free-radical theory of aging, based on its ready conversion into a hydroxyl radical.
Function

Eggs of sea urchin, shortly after fertilization by a sperm, produce hydrogen peroxide. It is then converted to hydroxyl radicals (HO•), which initiate radical polymerization, which surrounds the eggs with a protective layer of polymer.
The bombardier beetle combines hydroquinone and hydrogen peroxide, leading to a violent exothermic chemical reaction to produce boiling, foul-smelling liquid that partially becomes a gas (flash evaporation) and is expelled through an outlet valve with a loud popping sound.[41][42][43]
As a proposed signaling molecule, hydrogen peroxide may regulate a wide variety of biological processes.[44][45] At least one study has tried to link hydrogen peroxide production to cancer.[46]
الاستخدامات
التطبيقات الصناعية
التطبيقات الصناعية الرئيسية الأخرى لپروكسيد الهيدروجين تضم صناعة پركربونات الصوديوم وپربورات الصوديوم, المستخدَمان ك bleaches معتدل في منظفات الغسيل.
ويـُستخدم پروكسيد الهيدروجين كذلك في صناعة استكشاف النفط والغاز ليؤكسِد المكامن الصخرية إعداداً ل]]لتحليل الأحفوري الدقيق]] micro-fossil analysis.
وفي الصناعة الكيمياوية يُستعمل فوق أكسيد الهدروجين مؤكسِداً، ومادة أولية للحصول على المركبات فوق الأكسيدية المعدنية ومبادراً في البلمرة، ومبيضاً للحرير والصوف والريش والفرو.
الاستخدامات المنزلية

Hydrogen peroxide has various domestic uses, primarily as a cleaning and disinfecting agent.
- تبييض الشعر
Diluted H
2O
2 (between 1.9% and 12%) mixed with aqueous ammonia has been used to bleach human hair. The chemical's bleaching property lends its name to the phrase "peroxide blonde".[47]
Hydrogen peroxide is also used for tooth whitening. It may be found in most whitening toothpastes. Hydrogen peroxide has shown positive results involving teeth lightness and chroma shade parameters.[48] It works by oxidizing colored pigments onto the enamel where the shade of the tooth may become lighter. Hydrogen peroxide may be mixed with baking soda and salt to make a homemade toothpaste.[49]
- إزالة بقع الدم
Hydrogen peroxide reacts with blood as a bleaching agent, and so if a blood stain is fresh, or not too old, liberal application of hydrogen peroxide, if necessary in more than single application, will bleach the stain fully out. After about two minutes of the application, the blood should be firmly blotted out.[50][51]
- علاج حب الشباب
Hydrogen peroxide may be used to treat acne,[52] although benzoyl peroxide is a more common treatment.
- عامل تنظيف الفم
The use of dilute hydrogen peroxide as an oral cleansing agent has been reviewed academically to determine its usefulness in treating gingivitis and plaque. Although there is a positive effect when compared with a placebo, it was concluded that chlorhexidine is a much more effective treatment.[53]
يُعطي فوق أكسيد الهدروجين ذو التركيز العالي الذي يتفكك على الحفاز (الوسيط) catalyst المؤكسِد مزيجاً غازياً من الأكسجين وبخار الماء الساخن الذي تصل درجة حرارته حتى 700 ْس (غاز بخاري)، والذي يستعمل وقوداً في المحركات النفاثة.
وبما يتعلق بمشكلة تلوث البيئة من مخلفات النواتج الكيمياوية فإن فوق أكسيد الهدروجين يتميز بقيمة خاصة مؤكسداً نقياً لا يشكل نواتج سامة.
فوق أكسيد الهدروجين غير سام، لكن سقوط محاليله المركزة على الجلد أو الأغشية المخاطية أو في مجاري التنفس تسبب حروقاً في هذه الأماكن.
في الطب
وفي الطب يستعمل فوق أكسيد الهدروجين كأحد مستحضرات الوسائل المطهرة، ويستعمل محلوله بتركيز 3% للغسل والغرغرة عند التهاب الفم والتهاب اللوزتين وفي أمراض النساء ويستعمل أحياناً في توقيف النزيف الدموي الأنفي.
الاستخدام كدافع
السلامة
المصادر
الهامش
- ^ Easton MF, Mitchell AG, Wynne-Jones WF (1952). "The behaviour of mixtures of hydrogen peroxide and water. Part 1.—Determination of the densities of mixtures of hydrogen peroxide and water". Transactions of the Faraday Society. 48: 796–801. doi:10.1039/TF9524800796. S2CID 96669623.
- ^ "Hydrogen peroxide". www.chemsrc.com. Archived from the original on 17 March 2020. Retrieved 3 May 2018.
- ^ أ ب ت ث NIOSH Pocket Guide to Chemical Hazards 0335
- ^ أ ب ت "Hydrogen peroxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Brauer G, ed. (1963). Handbook of preparative inorganic chemistry. Vol. 1. Translation editing by Reed F. (2nd ed.). New York: Academic Press. p. 140. ISBN 978-0-12-126601-1.
- ^ Chernyshov IY, Vener MV, Prikhodchenko PV, Medvedev AG, Lev O, Churakov AV (2017-01-04). "Peroxosolvates: Formation Criteria, H2O2 Hydrogen Bonding, and Isomorphism with the Corresponding Hydrates". Crystal Growth & Design. 17 (1): 214–220. Bibcode:2017CrGrD..17..214C. doi:10.1021/acs.cgd.6b01449. ISSN 1528-7483.
- ^ Dougherty, Dennis A. (2005). Modern Physical Organic Chemistry. University Science. p. 122. ISBN 1-891389-31-9.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ رياض حجازي. "الماء الأكسجيني". الموسوعة العربية.
- ^ "Hydrogen Peroxide Technical Library" (PDF). Archived from the original (PDF) on 29 December 2009. Retrieved 3 March 2016.
- ^ L. J. Thenard (1818). Annales de chimie et de physique. 8: 308.
{{cite journal}}: Missing or empty|title=(help) - ^ Flohé L (December 2020). "Looking Back at the Early Stages of Redox Biology". Antioxidants. 9 (12): 1254. doi:10.3390/antiox9121254. PMC 7763103. PMID 33317108.
I checked Humboldt's pertinent publication carefully, but was unable to find an unambiguous proof of this assumption; the description of the starting materials ("Alaun-Erden" or "schwere Erden") were just too unprecise to understand what kind of chemical experiments he performed.
- ^ Gilbert LW (1820). "Der tropfbar flüssige Sauerstoff, oder das oxygenierte Wasser". Annals of Physics (in الألمانية). 65–66 (1): 3. Bibcode:1820AnP....64....1T. doi:10.1002/andp.18200640102.
- ^ Thénard LJ (1818). "Observations sur des nouvelles combinaisons entre l'oxigène et divers acides". Annales de chimie et de physique. 2nd series. 8: 306–312. Archived from the original on 3 September 2016. Retrieved 9 February 2016.
- ^ Giguère PA. "Hydrogen peroxide". Access Science. McGraw-Hill Education. doi:10.1036/1097-8542.329200. Archived from the original on 30 November 2018. Retrieved 28 November 2018.
Hydrogen peroxide was discovered in 1818 by the French chemist Louis-Jacques Thenard, who named it eau oxygénée (oxygenated water).
- ^ Jones CW, Clark JH (1999). Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry. ISBN 978-0-85404-536-5.
- ^ Offermanns H, Dittrich G, Steiner N (2000). "Wasserstoffperoxid in Umweltschutz und Synthese". Chemie in unserer Zeit. 34 (3): 150. doi:10.1002/1521-3781(200006)34:3<150::AID-CIUZ150>3.0.CO;2-A.
- ^ Wolffenstein R (October 1894). "Concentration und Destillation von Wasserstoffsuperoxyd". Berichte der Deutschen Chemischen Gesellschaft (in الألمانية). 27 (3): 3307–12. doi:10.1002/cber.189402703127. Archived from the original on 13 February 2016. Retrieved 29 June 2014.
- ^ Carrara G (1892). "Sul peso molecolare e sul potere rifrangente dell' acqua ossigenata" [On the molecular weight and on the refracting power of hydrogen peroxide]. Atti della Reale Accademia dei Lincei. 1 (2): 19–24. Archived from the original on 4 September 2016.
Carrara's findings were confirmed by: W. R. Orndorff and John White (1893) "The molecular weight of hydrogen peroxide and of benzoyl peroxide," Archived 4 سبتمبر 2016 at the Wayback Machine American Chemical Journal, 15 : 347–356. - ^ See, for example:
- In 1882, Kingzett proposed as a structure H
2O=O. See: Kingzett T (29 September 1882). "On the activity of oxygen and the mode of formation of hydrogen dioxide". The Chemical News. 46 (1192): 141–2. Archived from the original on 3 September 2016. Retrieved 9 February 2016. - In his 1922 textbook, Joseph Mellor considered three hypothetical molecular structures for hydrogen peroxide, admitting (p. 952): "... the constitution of this compound has not been yet established by unequivocal experiments". See: Joseph William Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, vol. 1 (London, England: Longmans, Green and Co., 1922), p. 952–956. Archived 3 سبتمبر 2016 at the Wayback Machine
- W. C. Schumb, C. N. Satterfield, and R. L. Wentworth (1 December 1953) "Report no. 43: Hydrogen peroxide, Part two" Archived 26 فبراير 2015 at the Wayback Machine, Office of Naval Research, Contract No. N5ori-07819 On p. 178, the authors present six hypothetical models (including cis-trans isomers) for hydrogen peroxide's molecular structure. On p. 184, the present structure is considered almost certainly correct—although a small doubt remained. (Note: The report by Schumb et al. was reprinted as: W. C. Schumb, C. N. Satterfield, and R. L. Wentworth, Hydrogen Peroxide (New York, New York: Reinhold Publishing Corp. (American Chemical Society Monograph), 1955).)
- In 1882, Kingzett proposed as a structure H
- ^ Penney WG, Sutherland GB (1934). "The theory of the structure of hydrogen peroxide and hydrazine". Journal of Chemical Physics. 2 (8): 492–8. Bibcode:1934JChPh...2..492P. doi:10.1063/1.1749518.
- ^ Penney WG, Sutherland GB (1934). "A note on the structure of H2O2 and H4N2 with particular reference to electric moments and free rotation". Transactions of the Faraday Society. 30: 898–902. doi:10.1039/tf934300898b.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةHageLienke - ^ أ ب ت Campos-Martin JM, Blanco-Brieva G, Fierro JL (October 2006). "Hydrogen peroxide synthesis: an outlook beyond the anthraquinone process". Angewandte Chemie. 45 (42): 6962–84. doi:10.1002/anie.200503779. PMID 17039551. S2CID 23286196.
- ^ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in the US, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ^ "Preparing to manufacture hydrogen peroxide" (PDF). IDC Technologies. Archived (PDF) from the original on 3 August 2021. Retrieved 14 February 2022.
- ^ Mellor JW (1922). Modern Inorganic Chemistry. Longmans, Green and Co. pp. 192–5.
- ^ Centi, Gabriele; Perathoner, Siglinda; Abate, Salvatore (2009), "Direct Synthesis of Hydrogen Peroxide: Recent Advances", Modern Heterogeneous Oxidation Catalysis, pp. 253–287, doi:, ISBN 978-3-527-31859-9
- ^ Edwards JK, Solsona B, N EN, Carley AF, Herzing AA, Kiely CJ, Hutchings GJ (February 2009). "Switching off hydrogen peroxide hydrogenation in the direct synthesis process". Science. 323 (5917): 1037–41. Bibcode:2009Sci...323.1037E. doi:10.1126/science.1168980. PMID 19229032. S2CID 1828874.
- ^ Wong, Chun Ming; Wong, Kwun Hei; Chen, Xiao Dong (2008). "Glucose oxidase: Natural Occurrence, Function, Properties and Industrial Applications". Applied Microbiology and Biotechnology. 78 (6): 927–938. doi:10.1007/s00253-008-1407-4. PMID 18330562. S2CID 2246466.
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed., pp. 321–322, Springer, Berlin 1988, ISBN 3-540-18163-6 (in German)
- ^ Gabaldón T (March 2010). "Peroxisome diversity and evolution". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 365 (1541): 765–773. doi:10.1098/rstb.2009.0240. PMC 2817229. PMID 20124343.
- ^ Wanders RJ, Waterham HR (2006). "Biochemistry of mammalian peroxisomes revisited". Annual Review of Biochemistry. 75 (1): 295–332. doi:10.1146/annurev.biochem.74.082803.133329. PMID 16756494.
- ^ Nelson D, Cox C, Lehninger AL, Cox MM (2001). Lehninger Biochemie (in German). Springer. pp. 663–4. ISBN 3-540-41813-X. Archived from the original on 28 February 2017.
{{cite book}}: CS1 maint: unrecognized language (link) - ^ أ ب Nelson, David; Cox, Michael; Lehninger, Albert L. and Cox, Michael M. Lehninger Biochemie, p. 932, Springer, 2001, ISBN 3-540-41813-X (in German)
- ^ Riley, Edward P. et al. (ed.) Fetal Alcoholspectrum Disorder Fasd: Management and Policy Perspectives Archived 28 فبراير 2017 at the Wayback Machine, Wiley-VCH, 2010, ISBN 3-527-32839-4 p. 112
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed., p. 288, Springer, Berlin 1988, ISBN 3-540-18163-6 (in German)
- ^ أ ب Halliwell B, Adhikary A, Dingfelder M, Dizdaroglu M (August 2021). "Hydroxyl radical is a significant player in oxidative DNA damage in vivo". Chem Soc Rev. 50 (15): 8355–60. doi:10.1039/d1cs00044f. PMC 8328964. PMID 34128512.
- ^ Giorgio M, Trinei M, Migliaccio E, Pelicci PG (September 2007). "Hydrogen peroxide: a metabolic by-product or a common mediator of ageing signals?". Nature Reviews. Molecular Cell Biology. 8 (9): 722–8. doi:10.1038/nrm2240. PMID 17700625. S2CID 6407526.
- ^ Gonzalez D, Bejarano I, Barriga C, Rodriguez AB, Pariente JA (2010). "Oxidative Stress-Induced Caspases are Regulated in Human Myeloid HL-60 Cells by Calcium Signal". Current Signal Transduction Therapy. 5 (2): 181–6. doi:10.2174/157436210791112172.
- ^ Bejarano I, Espino J, González-Flores D, Casado JG, Redondo PC, Rosado JA, et al. (September 2009). "Role of Calcium Signals on Hydrogen Peroxide-Induced Apoptosis in Human Myeloid HL-60 Cells". International Journal of Biomedical Science. 5 (3): 246–256. doi:10.59566/IJBS.2009.5246. PMC 3614781. PMID 23675144.
- ^ Schildknecht H, Holoubek K (1961). "The bombardier beetle and its chemical explosion". Angewandte Chemie. 73: 1–7. doi:10.1002/ange.19610730102.
- ^ Weber CG (Winter 1981). "The Bombardier Beetle Myth Exploded". Creation/Evolution. 2 (1): 1–5. Archived from the original on 29 September 2017. Retrieved 12 November 2017.
- ^ Isaak M (30 May 2003). "Bombardier Beetles and the Argument of Design". TalkOrigins Archive. Archived from the original on 16 November 2017. Retrieved 12 November 2017.
- ^ Veal EA, Day AM, Morgan BA (April 2007). "Hydrogen peroxide sensing and signaling". Molecular Cell. 26 (1): 1–14. doi:10.1016/j.molcel.2007.03.016. PMID 17434122.
- ^ "Wie Pflanzen sich schützen, Helmholtz-Institute of Biochemical Plant Pathology (in German)" (PDF) (in الألمانية). Helmholtz-Institute of Biochemical Plant Pathology. Archived from the original (PDF) on 23 July 2011. Retrieved 14 February 2022.
- ^ López-Lázaro M (July 2007). "Dual role of hydrogen peroxide in cancer: possible relevance to cancer chemoprevention and therapy". Cancer Letters. 252 (1): 1–8. doi:10.1016/j.canlet.2006.10.029. PMID 17150302.
- ^ Lane N (2003). Oxygen : the molecule that made the world (First issued in paperback, repr. ed.). Oxford: Oxford University Press. p. 117. ISBN 978-0-19-860783-0. Archived from the original on 13 April 2021. Retrieved 12 November 2020.
- ^ Sulieman M, Addy M, MacDonald E, Rees JS (May 2004). "The effect of hydrogen peroxide concentration on the outcome of tooth whitening: an in vitro study". Journal of Dentistry (in English). 32 (4): 295–9. doi:10.1016/j.jdent.2004.01.003. PMID 15053912.
{{cite journal}}: CS1 maint: unrecognized language (link) - ^ Shepherd S. "Brushing Up on Gum Disease". FDA Consumer. Archived from the original on 14 May 2007. Retrieved 7 July 2007.
- ^ Gibbs KB (14 November 2016). "How to remove blood stains from clothes and furniture". Today.com. Archived from the original on 20 May 2021. Retrieved 5 August 2021.
- ^ Mayntz M. "Dried Blood Stain Removal". Lovetoknow.com. Archived from the original on 17 August 2021. Retrieved 5 August 2021.
- ^ Capizzi R, Landi F, Milani M, Amerio P (August 2004). "Skin tolerability and efficacy of combination therapy with hydrogen peroxide stabilized cream and adapalene gel in comparison with benzoyl peroxide cream and adapalene gel in common acne. A randomized, investigator-masked, controlled trial". The British Journal of Dermatology. 151 (2): 481–4. doi:10.1111/j.1365-2133.2004.06067.x. PMID 15327558. S2CID 2611939.
- ^ Muniz, Francisco Wilker Mustafa Gomes; Cavagni, Juliano; Langa, Gerson Pedro José; Stewart, Bernal; Malheiros, Zilson; Rösing, Cassiano Kuchenbecker (2020-10-31). "A Systematic Review of the Effect of Oral Rinsing with H2O2 on Clinical and Microbiological Parameters Related to Plaque, Gingivitis, and Microbes". International Journal of Dentistry. 2020: 8841722. doi:10.1155/2020/8841722. ISSN 1687-8728. PMC 7648695. PMID 33178277.
ببليوجرافيا
- J. Drabowicz et al., in The Syntheses of Sulphones, Sulphoxides and Cyclic Sulphides, p112-116, G. Capozzi et al., eds., John Wiley & Sons, Chichester, UK, 1994. ISBN 0-471-93970-6.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997. A great description of properties & chemistry of H2O2.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- W. T. Hess, Hydrogen Peroxide, in Kirk-Othmer Encyclopedia of Chemical Technology, 4th edition, Wiley, New York, Vol.13, 961-995 (1995).
وصلات خارجية
- Hydrogen Peroxide Distillation for rocket fuel
- Material Safety Data Sheet
- ATSDR Agency for Toxic Substances and Disease Registry FAQ
- Negative effects of Hydrogen Peroxide as an oral rinse
- Food Grade Hydrogen Peroxide Information
- Experimental Rocket Propulsion Society
- International Chemical Safety Card 0164
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph "Hydrogen Peroxide"
- General Kinetics Inc. Hydrogen Peroxide Rocket Engines and Gas Generators
- Oxygenation Therapy:Unproven Treatments for Cancer and AIDS
- Hydrogen Peroxide in the Human Body
- Information on many common uses for hydrogen peroxide, especially household uses.
- Hydrogen peroxide in tooth whiteners summary by GreenFacts of the European Commission SCCP assessment
- CS1 errors: unsupported parameter
- CS1 errors: missing title
- CS1 الألمانية-language sources (de)
- CS1: Julian–Gregorian uncertainty
- Short description is different from Wikidata
- ECHA InfoCard ID from Wikidata
- Articles with unsourced statements from July 2015
- Articles containing unverified chemical infoboxes
- Chemical articles with unknown parameter in Chembox
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles containing فرنسية-language text
- جميع الصفحات التي تحتاج تنظيف
- مقالات بالمعرفة تحتاج توضيح from September 2020
- Articles with hatnote templates targeting a nonexistent page
- پروكسيد الهيدروجين
- معقمات
- Bleaches
- مطهرات
- كيماويات منزلية
- مركبات الهيدروجين
- كيماويات حساسة للضوء
- پيروكسيدات
- مؤكسدات الصواريخ
- تقديمات 1894
- متعلق بطب الأذن
- عوامل مؤكسدة
- فوق أكاسيد
- مركبات هيدروجين
- صناعة كيمياء النسيج

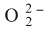
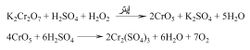


![{\displaystyle {\ce {->[{\ce {FAD}}]}}}](https://www.marefa.org/api/rest_v1/media/math/render/svg/cfe32866bbddda63271e58f329b21caad5946b64)