بورون
 boron (β-rhombohedral)[1] | |||||||||||||||
| بورون | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| التآصلات | α-, β-rhombohedral, β-tetragonal (و المزيد) | ||||||||||||||
| المظهر | black-brown | ||||||||||||||
| الوزن الذري العياري Ar°(B) | |||||||||||||||
| بورون في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 5 | ||||||||||||||
| المجموعة | 13 | ||||||||||||||
| الدورة | period 2 | ||||||||||||||
| المستوى الفرعي | p-block | ||||||||||||||
| التوزيع الإلكتروني | [He] 2s2 2p1 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 3 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | solid | ||||||||||||||
| نقطة الانصهار | 2349 K (2076 °س، 3769 °F) | ||||||||||||||
| نقطة الغليان | 4200 K (3927 °س، 7101 °ف) | ||||||||||||||
| الكثافة حين يكون سائلاً (عند ن.إ.) | 2.08 ج/سم³ | ||||||||||||||
| حرارة الانصهار | 50.2 kJ/mol | ||||||||||||||
| حرارة التبخر | 508 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 11.087 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 2.04 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 90 pm | ||||||||||||||
| نصف قطر التكافؤ | 84±3 pm | ||||||||||||||
| نصف قطر ڤان در ڤالز | 192 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| البنية البلورية | rhombohedral | ||||||||||||||
| سرعة الصوت قضيب رفيع | 16,200 م/ث (عند 20 °س) | ||||||||||||||
| قضيب رفيع | 27.4 W/(m·K) | ||||||||||||||
| التمدد الحراري | β form: 5–7 µm/(m⋅K) (عند 25 °س)[2] | ||||||||||||||
| المقاومة الكهربائية | ~106 Ω⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | diamagnetic[3] | ||||||||||||||
| القابلية المغناطيسية | −6.7×10−6 cm3/mol[3] | ||||||||||||||
| صلادة موز | ~9.5 | ||||||||||||||
| رقم كاس | 7440-42-8 | ||||||||||||||
| التاريخ | |||||||||||||||
| التسمية | after borax, from which it was isolated; Ultimately from Arabic بَوْرَق (bawraq) | ||||||||||||||
| الاكتشاف | Joseph Louis Gay-Lussac and Louis Jacques Thénard[4] (30 June 1808) | ||||||||||||||
| أول عزل | Humphry Davy[5] (9 July 1808) | ||||||||||||||
| نظائر البورون | |||||||||||||||
| قالب:جدول نظائر بورون | |||||||||||||||
البورون Boron هو عنصر كيميائي it has symbol B and atomic number 5. In its crystalline form it is a brittle, dark, lustrous metalloid; in its amorphous form it is a brown powder. As the lightest element of the boron group it has three valence electrons for forming covalent bonds, resulting in many compounds such as boric acid, the mineral sodium borate, and the ultra-hard crystals of boron carbide and boron nitride.
Boron is synthesized entirely by cosmic ray spallation and supernovas and not by stellar nucleosynthesis, so it is a low-abundance element in the Solar System and in the Earth's crust.[6] It constitutes about 0.001 percent by weight of Earth's crust.[7] It is concentrated on Earth by the water-solubility of its more common naturally occurring compounds, the borate minerals. These are mined industrially as evaporites, such as borax and kernite. The largest known deposits are in Turkey, the largest producer of boron minerals.
Elemental boron is found in small amounts in meteoroids, but chemically uncombined boron is not otherwise found naturally on Earth.
Several allotropes exist: amorphous boron is a brown powder; crystalline boron is silvery to black, extremely hard (9.3 on the Mohs scale), and a poor electrical conductor at room temperature (1.5 × 10−6 Ω−1 cm−1 room temperature electrical conductivity).[8] The primary use of the element itself is as boron filaments with applications similar to carbon fibers in some high-strength materials.
Boron is primarily used in chemical compounds. About half of all production consumed globally is an additive in fiberglass for insulation and structural materials. The next leading use is in polymers and ceramics in high-strength, lightweight structural and heat-resistant materials. Borosilicate glass is desired for its greater strength and thermal shock resistance than ordinary soda lime glass. As sodium perborate, it is used as a bleach. A small amount is used as a dopant in semiconductors, and reagent intermediates in the synthesis of organic fine chemicals. A few boron-containing organic pharmaceuticals are used or are in study. Natural boron is composed of two stable isotopes, one of which (boron-10) has a number of uses as a neutron-capturing agent.
Borates have low toxicity in mammals (similar to table salt) but are more toxic to arthropods and are occasionally used as insecticides. Boron-containing organic antibiotics are known. Although only traces are required, it is an essential plant nutrient.
التاريخ
The word boron was coined from borax, the mineral from which it was isolated, by analogy with carbon, which boron resembles chemically.[9]
Borax in its mineral form (then known as tincal) first saw use as a glaze, beginning in China circa 300 AD. Some crude borax traveled westward, and was apparently mentioned by the alchemist Jabir ibn Hayyan around 700 AD. Marco Polo brought some glazes back to Italy in the 13th century. Georgius Agricola, in around 1600, reported the use of borax as a flux in metallurgy. In 1777, boric acid was recognized in the hot springs (soffioni) near Florence, Italy, at which point it became known as sal sedativum, with ostensible medical benefits. The mineral was named sassolite, after Sasso Pisano in Italy. Sasso was the main source of European borax from 1827 to 1872, when American sources replaced it.[10][11] Boron compounds were rarely used until the late 1800s when Francis Marion Smith's Pacific Coast Borax Company first popularized and produced them in volume at low cost.[12]
Boron was not recognized as an element until it was isolated by Sir Humphry Davy[5] and by Joseph Louis Gay-Lussac and Louis Jacques Thénard.[4] In 1808 Davy observed that electric current sent through a solution of borates produced a brown precipitate on one of the electrodes. In his subsequent experiments, he used potassium to reduce boric acid instead of electrolysis. He produced enough boron to confirm a new element and named it boracium.[5] Gay-Lussac and Thénard used iron to reduce boric acid at high temperatures. By oxidizing boron with air, they showed that boric acid is its oxidation product.[4][13] Jöns Jacob Berzelius identified it as an element in 1824.[14] Pure boron was arguably first produced by the American chemist Ezekiel Weintraub in 1909.[15][16][17]
Characteristics of the element
Isotopes
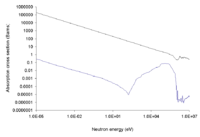
Boron has two naturally occurring and stable isotopes, 11B (80.1%) and 10B (19.9%). The mass difference results in a wide range of δ11B values, which are defined as a fractional difference between the 11B and 10B and traditionally expressed in parts per thousand, in natural waters ranging from −16 to +59. There are 13 known isotopes of boron; the shortest-lived isotope is 7B which decays through proton emission and alpha decay with a half-life of 3.5×10−22 s. Isotopic fractionation of boron is controlled by the exchange reactions of the boron species B(OH)3 and [B(OH)4]−. Boron isotopes are also fractionated during mineral crystallization, during H2O phase changes in hydrothermal systems, and during hydrothermal alteration of rock. The latter effect results in preferential removal of the [10B(OH)4]− ion onto clays. It results in solutions enriched in 11B(OH)3 and therefore may be responsible for the large 11B enrichment in seawater relative to both oceanic crust and continental crust; this difference may act as an isotopic signature.[18]
The exotic 17B exhibits a nuclear halo, i.e. its radius is appreciably larger than that predicted by the liquid drop model.[19]
NMR spectroscopy
Both 10B and 11B possess nuclear spin. The nuclear spin of 10B is 3 and that of 11B is 3/2. These isotopes are, therefore, of use in nuclear magnetic resonance spectroscopy; and spectrometers specially adapted to detecting the boron-11 nuclei are available commercially. The 10B and 11B nuclei also cause splitting in the resonances of attached nuclei.[20]
Allotropes
Boron forms four major allotropes: α-rhombohedral[21] and β-rhombohedral[22] (α-R and β-R), γ-orthorhombic[23] (γ) and β-tetragonal[24] (β-T). All four phases are stable at ambient conditions, and β-rhombohedral is the most common and stable. An α-tetragonal phase also exists (α-T), but is very difficult to produce without significant contamination. Most of the phases are based on B12 icosahedra, but the γ phase can be described as a rocksalt-type arrangement of the icosahedra and B2 atomic pairs.[25] It can be produced by compressing other boron phases to 12–20 GPa and heating to 1500–1800 °C; it remains stable after releasing the temperature and pressure. The β-T phase is produced at similar pressures, but higher temperatures of 1800–2200 °C. The α-T and β-T phases might coexist at ambient conditions, with the β-T phase being the more stable.[25][26][27] Compressing boron above 160 GPa produces a boron phase with an as yet unknown structure, and this phase is a superconductor at temperatures below 6–12 K.[28][29]
| Boron phase | α-R | β-R | γ | β-T |
|---|---|---|---|---|
| Symmetry | Rhombohedral | Rhombohedral | Orthorhombic | Tetragonal |
| Atoms/unit cell[25] | 12 | ~105 | 28 | |
| Density (g/cm3)[30][31][32][33] | 2.46 | 2.35 | 2.52 | 2.36 |
| Vickers hardness (GPa)[34][35] | 42 | 45 | 50–58 | |
| Bulk modulus (GPa)[35][36] | 185 | 224 | 227 | |
| Bandgap (eV)[35][37] | 2 | 1.6 | 2.1 |
Atomic structure
Atomic boron is the lightest element having an electron in a p-orbital in its ground state. Its first three ionization energies are higher than those for heavier group III elements, reflecting its electropositive character.[38]
Chemistry of the element
الخصائص
يتميز ببنية إلكترونية 1S22S2p1، وهذا يفسر تكافؤه الثلاثي لوجود ثلاثة إلكترونات في المدار الخارجي. ويكون في الطبيعة مزيجاً من نظيريْن كتلتاهما الذريتان 10 بنسبة 18.8 ٪ و11 بنسبة 81.2 ٪؛ تبلغ نسبته في الطبيعة (وفرته النسبية) نحو 5×10-3 ٪، ولا يوجد حراً في الطبيعة، وإنما يوجد في مركباته التي أهمها حمض البور والبوراكس وبيربورات الصوديوم.[39]
البورون عنصر شره للإلكترونات ، حيث أن لديه مدار p شاغر. ومركبات البورون تسلك سلوك أحماض لويس ، وإتحاده بسهولة مع المواد الغنية بالإلكترونات هو محأولة لإشباع طلب ذراته للإلترونات.
من خصائص البورون الضوئية أنه قادر على إنفاذ الإشعة التحت الحمراء. وفي درجات حرارة الغرفة يكون البورون موصلا سيئا للكهرباء ولكنه موصل جيد في درجات الحرارة العالية. للبورون أقوى تحمل للتوتر بين العناصر المعروفة.
يمكن استخدام نيتريد البورون لصناعة مواد قاسية ققسأوة الألماس. كما يقوم النيتريد كعازل كهربائي ولكنه يوصل الحرارة بشكل شبيه للفلزات. كما أن للبورون القدرة للعمل كمادة مقلله للإحتكاك تشبه تلك الموجودة لدى الجرافيت. والبورون يشبه الكربون أيضا في قدرته على تكوين شبكات جزيئية من روابط تكافئية مستقرة.
Elemental boron is rare and poorly studied because the pure material is extremely difficult to prepare. Most studies of "boron" involve samples that contain small amounts of carbon. Very pure boron is produced with difficulty because of contamination by carbon or other elements that resist removal.[40]
Some early routes to elemental boron involved the reduction of boric oxide with metals such as magnesium or aluminium. However, the product was often contaminated with borides of those metals.[41] Pure boron can be prepared by reducing volatile boron halides with hydrogen at high temperatures. Ultrapure boron for use in the semiconductor industry is produced by the decomposition of diborane at high temperatures and then further purified by the zone melting or Czochralski processes.[42]
Reactions of the element
Crystalline boron is a hard, black material with a melting point of above 2000 °C. Crystalline boron is chemically inert and resistant to attack by boiling hydrofluoric or hydrochloric acid. When finely divided, it is attacked slowly by hot concentrated hydrogen peroxide, hot concentrated nitric acid, hot sulfuric acid or hot mixture of sulfuric and chromic acids.[16]
Since elemental boron is very rare, its chemical reactions are of little significance practically speaking. The elemental form is not typically used as a precursor to compounds. Instead, the extensive inventory of boron compounds are produced from borates.[43]
When exposed to air, under normal conditions, a protective oxide or hydroxide layer forms on the surface of boron, which prevents further corrosion.[44] The rate of oxidation of boron depends on the crystallinity, particle size, purity and temperature. At higher temperatures boron burns to form boron trioxide:[45]
- 4 B + 3 O2 → 2 B2O3
استخداماته
أن أهم مركبات البورون إقتصاديا هو ثلاثي بورات ديكاهيدرات الصوديوم (sodium tetraborate decahydrate)Na2B4O7 · 10H2O، أو البورق المستخدم بكميات كبيرة في إنتاج الألياف الزجاجية العازلة ومواد التبييض ، استخدامات إخرى:
|
يمكن أكسدة هيدرات البورون بسهولة وتحرر كمية جيدة من الطاقة. ولذلك فهي تُدرس لإحتمالية استخدامها كوقود للصواريخ.
تاريخ
مركبات البورون (عرفها العرب بإسم البورق عن الفرس الذين عرفوها بإسم بوره) كانت معروفة منذ آلاف السنين. في مصر القديمة ، إعتمدت عملية تحنيط المومياء على خام يعرف بإسم نطرون، والذي يحوي على البوريتس وأملاح أخرى شائعة. واستخدم البوراكس في طلاء الزجاج في الصين منذ 300 ق.م.، كما أستخدم في صناعة الزجاج في روما القديمة.
لم يتم فصل عنصر البورون إلا عام 1808 على يد السير همفري ديفي ، غاي لوساك و ل. ج. ثينارد، حيث فصلوه حتى نسبة نقاوة 50%. لم يعرف هؤلاء كون المادة كانت عنصرا. وكان يونس ياكوب برزليوس الذي عرّفه كعنصر عام 1824. وتم إنتاج أول عينة من البورون الصرف على يد الكيميائي الأمريكي و. واينتراوب في عام 1909.
وجوده
الولايات الأمريكية المتحدة وتركيا هما أكبر منتجين للبورون في العالم. البورون لا يوجد في الطبيعة بشكل حر ولكن يوجد على شكل مركبات في البوراكس (بورق) ، حمض البوريك ، الكوليمانتين ، الكرنيت ، الأولوكسيت والبورات. يوجد حمض البوريك أحيانا في الينابيع البركانية. والأوليكسيت هو معدن من معادن البورون وله خصائص كتلك التي للألياف الزجاجية.
المصادر المهمة إقتصاديا تأتي من إحتياطيات خامات الكرنيت والتنكال (خامات البوراكس) والتان توجد كلاهما في صحراء موجافي في كاليفورنيا (البوراكس هو المصدر الأهم هناك) وتركيا فيها أيضا الكثير من خامات البوراكس.
في عام 1997 كانت تكلفة شكل بلوري من البورون بنقاء يصل إلى 99% حوالي 5 دولارات أمريكية لكل غرام وكانت تكلفة الشكل الغير متبلور (عديم الشكل) دولارين أمريكيين للغرام الواحد.
تحضيره
تحضير البورون النقي ليس بالعملة السهلة. الطرق الأولى التي استخدمت تضمنت إختزال أكسيد البوريك مع معادل كالمغنيسيوم أو الألمنيوم. ولكن الناتج كان في أكثر الأحيان يشوبه بورات المعدن المستخدم. ويمكن تحضير البورون النقي بإختزال شكل متطاير من البورون باستخدام الهيدرجين في درجات الحرارة العالية.
أما البور البلوري فيُحضَّر من إرجاع كلوريده بالهيدروجين بوساطة القوس الكهربائية ذات المسرى النحاسي. ويوجد البور اللابلوري على هيئة مسحوق أسود ـ كستنائي كثافته 1.7. أما البور البلوري فيوجد بشكل بلورات سوداء لامعة ذات قساوة عالية جداً، وكثافتها 2.3. يمكن استخدامها في السحج abrasion. ينصهر البور في درجة حرارة مقدارها 1200ْس، ويغلي في درجة حرارة تزيد على 2500ْس. تتناقص مقاومته الكهربائية بسرعة بازدياد الحرارة.
نظائره
للبورون نظيرين مستقرين موجودين في الطبيعية ، هما B-11 (80.1%)و B-10 (19.9%).
التفاعل
يسلك البور عموماً سلوك الجسم المرجع في درجات الحرارة المرتفعة، فهو يحترق بالأكسجين معطياً الأكسيد الموافق. ويتحد مع الهالوجينات بالحرارة معطياً الهاليدات من الشكل BX3. أما تفاعله مع الآزوت فلا يتم إلا في الدرجات المرتفعة من الحرارة، حيث يتشكل في الدرجة 1200ْس نتريد البور الذي يتمتع بدرجة انصهار عالية تبلغ نحو 3000ْس؛ لذلك فهو يستخدم في تبطين الأفران مادة تتحمل الحرارة وتعكسها. وبتسخين البور مع الكبريت يعطي كبريت البور ويشكل مع الهدْروجين الكثير من هيدريدات البور، أهمها ثنائي البوران B2H6 الذي يمكن استخدامه وقوداً في الطائرات والصواريخ.
أما مع المعادن فيعطي بالتسخين بوريد المعدن الموافق، ويتفاعل البور كذلك مع الأسس المصهورة ليعطي البورات مع انطلاق الهدروجين. وينحل البور في حمض الآزوت المركز، ويمكن تحسين بعض صفات الحديد الصب بإضافة البور إليه. ويؤدي البور دوراً بيولوجياً مهماً في عالم النبات إذ تراوح نسبته مابين 2.3 و11.3 ميللغرام بور في كل 1 كغ من المادة الجافة في أحاديات الفلقة monocotyledons؛ أما نسبته في ذوات الفلقتين diciotyledons فهي تراوح بين 8 و95 مغ لكل 1 كغ من المادة.
يعد ثلاثي أكسيد البور هذا في الأكاسيد المذبذبة amphoteric، وإن كان أكثر حمضية من أكسيد الألمنيوم. ويصنف على أنه بلاما حمض البور، الذي يُحضَّر من تأثير حمض الكبريت في البوراكس Na2B4O7.10H2O. ويعد حمض البور في الحموض الضعيفة ويسلك في المحاليل سلوك آخذ للإلكترونات، ويدخل في صناعة بعض الأدوية الصيدلانية مادةً معقمة، ويساعد على حفظ الأطعمة، كما يستعمل في صناعة بورات الصوديوم والبوراكس، وهي مواد ذات أهمية في صناعة الخزف وبعض أنواع الزجاج (البيركس) إذ يفيد في إنقاص عامل تمددها الحراري.
ويشكل البور مع الهالوجينات، على غرار الألمنيوم، ثلاثي الهاليد، وهي مركبات ذات طبيعة مشتركة covalent ومتطايرة، يتناقص تطايرها بازدياد الوزن الجزيئي للهاليد. وتتحلل هاليدات البور بسرعة في الماء.
تحذيرات
عنصر البورون والبورات ليست سامّة ولذلك فإنه لا يوجد إجراءات خاصة يجب القيام بها عند التعامل معه. ولكن بعض مركبات البورون والهيدرجين سامّة وتحتاج إلى معاملة خاصّة.
انظر أيضاً
المصادر
- ^ Van Setten et al. 2007, pp. 2460–1
- ^ Holcombe Jr., C. E.; Smith, D. D.; Lorc, J. D.; Duerlesen, W. K.; Carpenter; D. A. (October 1973). "Physical-Chemical Properties of beta-Rhombohedral Boron". High Temp. Sci. 5 (5): 349–57.
- ^ أ ب Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. p. 4.127. ISBN 9781498754293.
- ^ أ ب ت Gay Lussac, J.L.; Thenard, L.J. (1808). "Sur la décomposition et la recomposition de l'acide boracique". Annales de chimie. 68: 169–174.
- ^ أ ب ت Davy H (1809). "An account of some new analytical researches on the nature of certain bodies, particularly the alkalies, phosphorus, sulphur, carbonaceous matter, and the acids hitherto undecomposed: with some general observations on chemical theory". Philosophical Transactions of the Royal Society of London. 99: 39–104. doi:10.1098/rstl.1809.0005.
- ^ "Q & A: Where does the element Boron come from?". physics.illinois.edu. Archived from the original on 29 May 2012. Retrieved 4 December 2011.
- ^ "Boron". Britannica encyclopedia. Archived from the original on 4 August 2020. Retrieved 4 August 2020.
- ^ Kirk-Othmer, ed. (26 January 2001). Kirk-Othmer Encyclopedia of Chemical Technology (in الإنجليزية) (1 ed.). Wiley. doi:10.1002/0471238961.0215181510011419.a01.pub2. ISBN 978-0-471-48494-3.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 139. ISBN 978-0-08-037941-8.
- ^ Garrett, Donald E. (1998). Borates: handbook of deposits, processing, properties, and use. Academic Press. pp. 102, 385–386. ISBN 978-0-12-276060-0.
- ^ Calvert, J. B. "Boron". University of Denver. Archived from the original on 24 September 2018. Retrieved 5 May 2009.
- ^ Hildebrand, G. H. (1982) "Borax Pioneer: Francis Marion Smith." San Diego: Howell-North Books. p. 267 ISBN 0-8310-7148-6
- ^ Weeks, Mary Elvira (1933). "XII. Other Elements Isolated with the Aid of Potassium and Sodium: Beryllium, Boron, Silicon and Aluminum". The Discovery of the Elements. Easton, PA: Journal of Chemical Education. p. 156. ISBN 978-0-7661-3872-8. Archived from the original on 20 September 2014. Retrieved 5 January 2016.
- ^ Berzelius produced boron by reducing a borofluoride salt; specifically, by heating potassium borofluoride with potassium metal. See: Berzelius, J. (1824) "Undersökning af flusspatssyran och dess märkvärdigaste föreningar" Archived 13 يونيو 2016 at the Wayback Machine (Part 2) (Investigation of hydrofluoric acid and of its most noteworthy compounds), Kongliga Vetenskaps-Academiens Handlingar (Proceedings of the Royal Science Academy), vol. 12, pp. 46–98; see especially pp. 88ff. Reprinted in German as: Berzelius, J. J. (1824) "Untersuchungen über die Flußspathsäure und deren merkwürdigste Verbindungen" Archived 8 يناير 2017 at the Wayback Machine, Poggendorff's Annalen der Physik und Chemie, vol. 78, pages 113–150.
- ^ Weintraub, Ezekiel (1910). "Preparation and properties of pure boron". Transactions of the American Electrochemical Society. 16: 165–184. Archived from the original on 9 May 2016. Retrieved 5 January 2016.
- ^ أ ب Laubengayer, A. W.; Hurd, D. T.; Newkirk, A. E.; Hoard, J. L. (1943). "Boron. I. Preparation and Properties of Pure Crystalline Boron". Journal of the American Chemical Society. 65 (10): 1924–1931. Bibcode:1943JAChS..65.1924L. doi:10.1021/ja01250a036.
- ^ Borchert, W.; Dietz, W.; Koelker, H. (1970). "Crystal Growth of Beta–Rhombohedrical Boron". Zeitschrift für Angewandte Physik. 29: 277. OSTI 4098583.
- ^ Barth, S. (1997). "Boron isotopic analysis of natural fresh and saline waters by negative thermal ionization mass spectrometry". Chemical Geology. 143 (3–4): 255–261. Bibcode:1997ChGeo.143..255B. doi:10.1016/S0009-2541(97)00107-1.
- ^ Liu, Z. (2003). "Two-body and three-body halo nuclei". Science China Physics, Mechanics & Astronomy. 46 (4): 441. Bibcode:2003ScChG..46..441L. doi:10.1360/03yw0027 (inactive 3 May 2025). S2CID 121922481.
{{cite journal}}: CS1 maint: DOI inactive as of مايو 2025 (link) - ^ "Boron NMR". BRUKER Biospin. Archived from the original on 2 May 2009. Retrieved 5 May 2009.
- ^ "visualisisation of the crystal structure". Archived from the original on 4 November 2023. Retrieved 4 November 2023.
- ^ "visualisisation of the crystal structure". Archived from the original on 4 November 2023. Retrieved 4 November 2023.
- ^ "visualisisation of the crystal structure". Archived from the original on 4 November 2023. Retrieved 4 November 2023.
- ^ "visualisisation of the crystal structure". Archived from the original on 4 November 2023. Retrieved 4 November 2023.
- ^ أ ب ت Oganov A.R.; Chen J.; Gatti C.; Ma Y.-M.; Yu T.; Liu Z.; Glass C.W.; Ma Y.-Z.; Kurakevych O.O.; Solozhenko V.L. (2009). "Ionic high-pressure form of elemental boron" (PDF). Nature. 457 (7231): 863–867. arXiv:0911.3192. Bibcode:2009Natur.457..863O. doi:10.1038/nature07736. PMID 19182772. S2CID 4412568. Archived (PDF) from the original on 28 July 2018. Retrieved 9 May 2009.
- ^ van Setten M.J.; Uijttewaal M.A.; de Wijs G.A.; de Groot R.A. (2007). "Thermodynamic stability of boron: The role of defects and zero point motion" (PDF). J. Am. Chem. Soc. 129 (9): 2458–2465. Bibcode:2007JAChS.129.2458V. doi:10.1021/ja0631246. PMID 17295480. S2CID 961904. Archived from the original (PDF) on 15 April 2021. Retrieved 14 July 2019.
- ^ Widom M.; Mihalkovic M. (2008). "Symmetry-broken crystal structure of elemental boron at low temperature". Phys. Rev. B. 77 (6): 064113. arXiv:0712.0530. Bibcode:2008PhRvB..77f4113W. doi:10.1103/PhysRevB.77.064113. S2CID 27321818.
- ^ Eremets, M. I.; Struzhkin, V. V.; Mao, H.; Hemley, R. J. (2001). "Superconductivity in Boron". Science. 293 (5528): 272–4. Bibcode:2001Sci...293..272E. doi:10.1126/science.1062286. PMID 11452118. S2CID 23001035.
- ^ Zarechnaya E. Y.; et al. (2009). "Superhard semiconducting optically transparent high pressure phase of boron". Physical Review Letters. 102 (18): 185501–185501–4. Bibcode:2009PhRvL.102r5501Z. doi:10.1103/PhysRevLett.102.185501. PMID 19518885. structure determination
- ^ Wentorf, R. H. Jr (1 January 1965). "Boron: Another Form". Science. 147 (3653): 49–50. Bibcode:1965Sci...147...49W. doi:10.1126/science.147.3653.49. PMID 17799779. S2CID 20539654.
- ^ Hoard, J. L.; Sullenger, D. B.; Kennard, C. H. L.; Hughes, R. E. (1970). "The structure analysis of β-rhombohedral boron". J. Solid State Chem. 1 (2): 268–277. Bibcode:1970JSSCh...1..268H. doi:10.1016/0022-4596(70)90022-8.
- ^ Will, G.; Kiefer, B. (2001). "Electron Deformation Density in Rhombohedral a-Boron". Zeitschrift für Anorganische und Allgemeine Chemie. 627 (9): 2100. doi:10.1002/1521-3749(200109)627:9<2100::AID-ZAAC2100>3.0.CO;2-G.
- ^ Talley, C. P.; LaPlaca, S.; Post, B. (1960). "A new polymorph of boron". Acta Crystallogr. 13 (3): 271–272. Bibcode:1960AcCry..13..271T. doi:10.1107/S0365110X60000613.
- ^ Solozhenko, V. L.; Kurakevych, O. O.; Oganov, A. R. (2008). "On the hardness of a new boron phase, orthorhombic γ-B28". Journal of Superhard Materials. 30 (6): 428–429. arXiv:1101.2959. Bibcode:2008JSMat..30..428S. doi:10.3103/S1063457608060117. S2CID 15066841.
- ^ أ ب ت Zarechnaya, E. Yu.; Dubrovinsky, L.; Dubrovinskaia, N.; Filinchuk, Y.; Chernyshov, D.; Dmitriev, V.; Miyajima, N.; El Goresy, A.; Braun, H. F.; van Smaalen, S.; Kantor, I.; Kantor, A.; Prakapenka, V.; Hanfland, M.; Mikhaylushkin, A. S.; Abrikosov, I. A.; Simak, S. I. (2009). "Superhard Semiconducting Optically Transparent High Pressure Phase of Boron". Phys. Rev. Lett. 102 (18): 185501. Bibcode:2009PhRvL.102r5501Z. doi:10.1103/PhysRevLett.102.185501. PMID 19518885.
- ^ Nelmes, R. J.; Loveday, J. S.; Allan, D. R.; Hull, S.; Hamel, G.; Grima, P.; Hull, S. (1993). "Neutron- and x-ray-diffraction measurements of the bulk modulus of boron". Phys. Rev. B. 47 (13): 7668–7673. Bibcode:1993PhRvB..47.7668N. doi:10.1103/PhysRevB.47.7668. PMID 10004773.
- ^ Madelung, O., ed. (1983). Landolt-Bornstein, New Series. Vol. 17e. Berlin: Springer-Verlag.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 144. ISBN 978-0-08-037941-8.
- ^ عبد المجيد البلخي. "البور". الموسوعة العربية. Retrieved 2012-04-19.
- ^ Hobbs, Dale Z.; Campbell, Thomas T.; Block, F. E. (1964). Methods Used in Preparing Boron (in الإنجليزية). U.S. Department of the Interior, Bureau of Mines. p. 14. Archived from the original on 8 March 2024. Retrieved 25 February 2022.
- ^ Springborg, Michael (1 September 2011). Chemical Modelling: Applications and Theory Volume 8 (in الإنجليزية). Royal Society of Chemistry. pp. 2–3. ISBN 978-1-84973-278-9.
- ^ Berger, L. I. (1996). Semiconductor materials. CRC Press. pp. 37–43. ISBN 978-0-8493-8912-2.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةBrotherton - ^ Chintersingh, Kerri-Lee; Schoenitz, Mirko; Dreizin, Edward L. (November 2016). "Oxidation kinetics and combustion of boron particles with modified surface". Combustion and Flame (in الإنجليزية). 173: 288–295. Bibcode:2016CoFl..173..288C. doi:10.1016/j.combustflame.2016.08.027.
- ^ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Bor". Lehrbuch der Anorganischen Chemie (in الألمانية) (91–100 ed.). Walter de Gruyter. pp. 814–864. ISBN 978-3-11-007511-3.
مراجع للإستزادة
- عبد المجيد البلخي، محمد علي المنجد، الكيمياء اللاعضوية (2)، (منشورات جامعة دمشق 1981 - 1982).
- قاسم أم الزين، المولوي عبد الكافي، الهادي زروق، كيمياء العناصر (المنظمة العربية للتربية والثقافة والعلوم).
- F.A.Cotton & G.Wilkinson, Advanced Inorganic Chemistry (John Wiley & sons 1980).