هيدروكسيد الصوديوم
 | |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
هيدروكسيد الصوديوم[3]
| |
| أسماء أخرى | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.013.805 |
| رقم EC |
|
| E number | E524 (acidity regulators, ...) |
| مرجع Gmelin | 68430 |
| KEGG | |
| عناوين مواضيع طبية MeSH | |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
| UN number | 1823 (المادة الصلبة) 1824 (المحلول) |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | NaOH |
| كتلة مولية | 39.9971 جم/مول |
| المظهر | بلورات بيضاء غير شفافة |
| الرائحة | عديم الرائحة |
| الكثافة | 2.13 كم/سم3[4] |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 418 كم/لتر (0 °س) 1000 g/L (25 °س)[4] 3370 جم/لتر (100 °س) |
| قابلية الذوبان | قابل للذوبان في الگليسرول، يذوب بصعوبة في الأمونيا، غير قابل للذوبان في الأثير، قابل للذوبان ببطء في گليكول الپروپيل |
| قابلية الذوبان في الميثانول | 238 جم/لتر |
| قابلية الذوبان في الإيثانول | 139 جم/لتر |
| ضغط البخار | <2.4 kPa (20 °س) 0.1 kPa (700 °س) |
| الحموضة (pKa) | 13.9 (Na+)[5] |
| القاعدية (pKb) | 0.0 (OH−)[6] |
| القابلية المغناطيسية | −15.8·10−6 cm3/mol (aq.)[7] |
| معامل الانكسار (nD) | 1.3576 |
| البنية | |
| البنية البلورية | Orthorhombic, oS8 |
| الزمرة الفراغية | Cmcm, No. 63 |
| ثابت العقد | a = 0.34013 nm, b = 1.1378 nm, c = 0.33984 nm |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−425.8 kJ/mol |
| Standard molar entropy S |
64.4 J/(mol·K) |
| سعة الحرارة النوعية، C | 59.5 J/(mol·K) |
| المخاطر | |
| صفحة بيانات السلامة | External SDS |
| ن.م.ع. مخطط تصويري |  
|
| ن.م.ع. كلمة الاشارة | خطر |
| H290, H302, H314 | |
| P280, P305+P351+P338, P310 | |
| NFPA 704 (معيـَّن النار) | |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
40 ملج/كجم (mouse, intraperitoneal)[9] 140 - 340 mg/kg (rat, oral) 1350 mg/kg (rabbit, dermal) |
LDLo (المنشورة الأقل)
|
500 ملجم/كجم (الأرانب، فموي)[10] |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |
PEL (المسموح)
|
TWA 2 ملج/م3[8] |
REL (الموصى به)
|
C 2 mg/m3[8] |
IDLH (خطر عاجل)
|
10 mg/m3[8] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
|
كاتيونات أخرى
|
|
مركـّبات ذات علاقة
|
|
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
هيدروكسيد الصوديوم (Sodium hydroxide)، أو الصودا الكاوية (caustic soda)،[1][2] هو مركب غير عضوي صيغته الكيميائية NaOH. وهو مركب أيوني أبيض اللون يتكون من كاتيونات الصوديوم Na+
وأنيونات الهيدروكسيد OH−
.
هيدروكسيد الصوديوم هي قاعدة قلوية آكالة قوية، تُحلل الدهون والپروتينات في درجات الحرارة المحيطة، وقد تُسبب حروقاً كيميائية شديدة. هيدروكسيد الصوديوم شديد الذوبان في الماء، ويمتص الرطوبة وثاني أكسيد الكربون من الهواء بسهولة. يُشكل سلسلة من الهيدرات NaOH·nH
2O.[11] يتبلور أحادي الهيدرات NaOH·H2O من محاليل مائية تتراوح حرارتها بين 12.3 و61.8 درجة مئوية. غالباً ما يكون "هيدروكسيد الصوديوم" المتوفر تجارياً هو أحادي الهيدرات هذا، وقد تُشير البيانات المنشورة إليه بدلاً من المركب اللامائي.
باعتباره أحد أبسط الهيدروكسيدات، يُستخدم هيدروكسيد الصوديوم بشكل متكرر إلى جانب الماء المحايد وحمض الهيدروكلوريك الحمضي لإظهار مقياس الأس الهيدروجيني لطلبة الكيمياء.[12]
يُستخدم هيدروكسيد الصوديوم في العديد من الصناعات منها؛ صناعة لب الخشب والورق، المنسوجات، مياه الشرب، الصابون والمنظفات، وكمنظف مصارف كيميائي. عام 2022 بلغ الإنتاج العالمي من هيدروكسيد الصوديوم حوالي 83 مليون طن.[13]
الخصائص
الخصائص الفيزيائية
هيدروكسيد الصوديوم النقي هو مادة صلبة بلورية عديمة اللون، تذوب عند درجة حرارة 318 درجة مئوية دون تحلل، وتغلي عند درجة حرارة 1388 درجة مئوية. وهو شديد الذوبان في الماء، مع ذوبان أقل في المذيبات القطبية مثل الإيثانول والميثانول.[14] هيدروكسيد الصوديوم غير قابل للذوبان في الإيثر والمذيبات غير القطبية الأخرى.
على غرار ترطيب حمض الكبريتيك، فإن ذوبان هيدروكسيد الصوديوم الصلب في الماء هو تفاعل طارد للحرارة بدرجة عالية[15] حيث تنطلق كمية كبيرة من الحرارة، مما يُشكل خطراً على السلامة لاحتمالية تناثرها. عادةً ما يكون المحلول الناتج عديم اللون والرائحة. وكما هو الحال مع المحاليل القلوية الأخرى، يكون زلقاً عند ملامسته للجلد نتيجةً لعملية التصبن التي تحدث بين هيدروكسيد الصوديوم وزيوت البشرة الطبيعية.
اللزوجة
تتميز محاليل هيدروكسيد الصوديوم المائية المركزة (50%) بلزوجة مميزة تبلغ 78 مل پاسكال/ثانية، وهي أعلى بكثير من لزوجة الماء (1.0 مل پاسكال/ثانية) وقريبة من لزوجة زيت الزيتون (85 مل پاسكال/ثانية) في درجة حرارة الغرفة. وتتناسب لزوجة هيدروكسيد الصوديوم المائي، كما هو الحال مع أي مادة كيميائية سائلة، عكسياً مع درجة حرارته، أي أن لزوجته تنخفض بارتفاع درجة الحرارة، والعكس صحيح. وتلعب لزوجة محاليل هيدروكسيد الصوديوم دوراً مباشراً في استخدامها وتخزينها.[14]
الهيدرات
يمكن لهيدروكسيد الصوديوم أن يشكل عدة هيدرات NaOH·nH
2O، مما ينتج عنه مخطط ذوبان معقد وصف بالتفصيل سپنسر أومفرڤيل پيكرينگ عام 1893.[16] الهيدرات المعروفة والنطاقات التقريبية لدرجة الحرارة والتركيز (النسبة المئوية للكتلة من NaOH) لمحاليلها المائية المشبعة هي:[11]
- سباعي الهيدرات، NaOH·7H2O: من −28 °س (18.8%) إلى −24 °س (22.2%).[16]
- خماسي الهيدرات، NaOH·5H2O: من −24 °س (22.2%) إلى −17.7 °س (24.8%).[16]
- رباعي الهيدرات، NaOH·4H2O، ألفا من : من −17.7 °س (24.8%) ‘لى 5.4 °س (32.5%).[16][17]
- رباعي الهيدرات، NaOH·4H2O، بيتا من: غير مستقر.[16][17]
- Trihemihydrate, NaOH·3.5H2O: from 5.4 °C (32.5%) to 15.38 °C (38.8%) and then to 5.0 °C (45.7%).[16][11]
- Trihydrate, NaOH·3H2O: metastable.[16]
- ثنائي الهيدرات، NaOH·2H2O: من 5.0 °س (45.7%) إلى 12.3 °س (51%).[16][11]
- أحادي الهيدرات، NaOH·H2O: من 12.3 °س (51%) إلى 65.10 °س (69%) ثم إلى 62.63 °س (73.1%).[16][18]
تشير التقارير المبكرة إلى الهيدرات في حالة n = 0.5 أو n = 2/3، لكن التحقيقات الدقيقة اللاحقة فشلت في تأكيد وجودها.[18]
الهيدرات الوحيدة ذات درجات الانصهار المستقرة هي NaOH·H2O (65.10 °س) وNaOH·3.5H2O (15.38 °س). أما الهيدرات الأخرى، باستثناء الهيدرات شبه المستقرة NaOH·3H2O وNaOH·4H2O (β)، فيمكن تبلورها من محاليل ذات التركيب المناسب، كما هو مذكور أعلاه. ومع ذلك، يمكن تبريد محاليل NaOH بسهولة فائقة بدرجات عديدة، مما يسمح بتكوين الهيدرات (بما في ذلك الهيدرات شبه المستقرة) من محاليل ذات تركيزات مختلفة.[11][18]
على سبيل المثال، عند تبريد محلول من هيدروكسيد الصوديوم (NaOH) وماء بنسبة مولية 1:2 (52.6% NaOH كتلةً)، يبدأ أحادي الهيدرات بالتبلور عادة (عند حوالي 22 °س) قبل ثنائي الهيدرات. ومع ذلك، يُمكن تبريد المحلول تبريداً فائقاً بسهولة إلى -15 °س، وعند هذه النقطة قد يتبلور بسرعة على شكل ثنائي الهيدرات. عند تسخينه، قد يذوب ثنائي الهيدرات الصلب مباشرةً في محلول عند درجة حرارة 13.35 °س؛ لكن بمجرد أن تتجاوز درجة الحرارة 12.58 °س، فإنه غالباً ما يتحلل إلى أحادي الهيدرات الصلب ومحلول سائل. حتى الهيدرات "n" = 3.5 يصعب تبلوره، لأن المحلول يبرد تبريداً فائقاً لدرجة أن الهيدرات الأخرى تصبح أكثر استقراراً.[11]
محلول الماء الساخن الذي يحتوي على 73.1% (كتلة) من NaOH هو مادة سهلة الانصهار تتصلب عند حوالي 62.63 °س كمزيج حميم من البلورات اللامائية والأحادية الهيدرات.[19][18]
يتكون المركب سهل الانصهار المستقر الثاني تتكون من 45.4% (كتلة) من NaOH، والتي تتصلب عند حوالي 4.9 °س في خليط من بلورات ثنائي الهيدرات و3.5 هيدرات.[11]
يحتوي المركب الإيتكتيكي المستقر الثالث على 18.4% (كتلة) من هيدروكسيد الصوديوم. يتصلب عند حوالي -28.7 °س كمزيج من جليد الماء وسباعي الهيدرات NaOH·7H2O.[16][20]
عند تبريد المحاليل التي تحتوي على أقل من 18.4% من هيدروكسيد الصوديوم، يتبلور الماء الجليد أولاً، تاركاً هيدروكسيد الصوديوم في المحلول.[16]
الشكل ألفا من رباعي الهيدرات كثافته 1.33 جم/سم³. ينصهر بشكل متجانس عند درجة حرارة 7.55 °س إلى سائل يحتوي على 35.7% من هيدروكسيد الصوديوم (NaOH) وكثافة 1.392 جم/سم³، وبالتالي يطفو عليه كالثلج على الماء. مع ذلك، عند درجة حرارة حوالي 4.9 °س، قد ينصهر بشكل متجانس إلى خليط من مادة صلبة ({chem2|NaOH*3.5H2O}}) ومحلول سائل.[17]
الشكل بيتا من رباعي الهيدرات غير مستقر، وغالباً ما يتحول تلقائياً إلى الشكل ألفا عند تبريده إلى أقل من −20 °س.[17] بمجرد بدء عملية التحول الطارد للحرارة، يكتمل في غضون دقائق قليلة، مع زيادة في حجم المادة الصلبة بنسبة 6.5%. يمكن بلورة الشكل بيتا من محاليل فائقة التبريد عند درجة حرارة -26 °س، وينصهر جزئيًا عند درجة حرارة -1.83 °س.[17]
غالباً ما يكون "هيدروكسيد الصوديوم" التجاري أحادي الهيدرات (كثافة 1.829 جم/سم³). قد تشير البيانات الفيزيائية في الأدبيات التقنية إلى هذا الشكل، بدلاً من المركب اللامائي.
التركيب البلوري
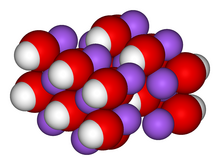
يُشكّل هيدروكسيد الصوديوم (NaOH) وجزيئاته الأحادية الهيدرات بلوراتٍ مُعينية الشكل ذات مجموعات فراغية Cmcm (oS8) وPbca (P24)، على التوالي. أبعاد خلية أحادي الهيدرات هي a = 1.1825، b = 0.6213، c = 0.6069 نانومتر. تُرتّب الذرات في بنية طبقية تُشبه بنية الهيدرارجيليت، حيث تُحيط كل ذرة صوديوم بست ذرات أكسجين، ثلاث منها من أيونات الهيدروكسيد وثلاث من جزيئات الماء. تُشكّل ذرات الهيدروجين في الهيدروكسيل روابط قوية مع ذرات الأكسجين داخل كل طبقة من الأكسجين. ترتبط طبقات الأكسجين المتجاورة ببعضها بواسطة روابط هيدروجينية بين جزيئات الماء.[21]
الخصائص الكيميائية
التفاعل مع الأحماض
يتفاعل هيدروكسيد الصوديوم مع الأحماض الپروتونية لإنتاج الماء والأملاح المقابلة. على سبيل المثال، عندما يتفاعل هيدروكسيد الصوديوم مع حمض الهيدروكلوريك، يتكون كلوريد الصوديوم:
- NaOH(aq) + HCl(aq) → NaCl(aq) + H
2O(l)
بشكل عام، يتم تمثيل تفاعلات التعادل هذه بمعادلة أيونية صافية بسيطة واحدة:
- OH−
(aq) + H+
(aq) → H
2O(l)
هذا النوع من التفاعلات مع حمض قوي يُطلق حرارة، وبالتالي فهو تفاعل طارد للحرارة. يمكن استخدام تفاعلات الحمض-القلوي كهذه أيضاً في المعايرة. مع ذلك، لا يستخدم هيدروكسيد الصوديوم كمعيار أولي لأنه ماص للرطوبة ويمتص ثاني أكسيد الكربون من الهواء.
التفاعل مع الأكاسيد الحمضية
يتفاعل هيدروكسيد الصوديوم أيضاً مع أكاسيد حمضية، مثل ثاني أكسيد الكبريت. تُستخدم هذه التفاعلات غالباً "لغسل" الغازات الحمضية الضارة (مثل SO
2 وH
2S) الناتجة عن حرق الفحم، وبالتالي منع انبعاثها في الغلاف الجوي. على سبيل المثال،
- 2 NaOH + SO
2 → Na
2SO
3 + H
2O
التفاعل مع الفلزات والأكاسيد
يتفاعل الزجاج ببطء مع محاليل هيدروكسيد الصوديوم المائية في درجات الحرارة المحيطة لتكوين سيليكات قابلة للذوبان. نتيجةً لذلك، تميل الوصلات والمحابس الزجاجية المعرضة لهيدروكسيد الصوديوم إلى التجمد. تتضرر الدوارق والمفاعلات الكيميائية المبطنة بالزجاج نتيجة التعرض الطويل لهيدروكسيد الصوديوم الساخن، مما يُجمد الزجاج أيضاً. لا يؤثر هيدروكسيد الصوديوم على الحديد في درجة حرارة الغرفة، لأن الحديد لا يمتلك خواصاً تذبذبية (أي أنه يذوب فقط في الحمض، وليس في القاعدة). ومع ذلك، عند درجات الحرارة العالية (على سبيل المثال أعلى من 500°س)، يمكن للحديد أن يتفاعل بشكل ماص للحرارة مع هيدروكسيد الصوديوم لتكوين ثالث أكسيد الحديد، وفلز الصوديوم، وغاز الهيدروجين.[22] يعود ذلك إلى انخفاض محتوى ثالث أكسيد الحديد (−824.2 كيلوجول/مول) مقارنة بهيدروكسيد الصوديوم (−500 كيلوجول/مول) والتغير الإيجابي في عشوائية التفاعل الداخلية، مما يعني تلقائية التفاعل عند درجات الحرارة العالية (ΔST > ΔH، ΔG < 0) وعدم تلقائيته عند درجات الحرارة المنخفضة (ΔST < ΔH، ΔG > 0). لننظر إلى التفاعل التالي بين هيدروكسيد الصوديوم المنصهر وبرادة الحديد الدقيقة:
- 4 Fe + 6 NaOH → 2 Fe
2O
3 + 6 Na + 3 H
2
ومع ذلك، قد تتفاعل بعض الفلزات الانتقالية بقوة مع هيدروكسيد الصوديوم في ظل ظروف أكثر اعتدالاً.
عام 1986، أُستخدمت شاحنة طرق من الألومنيوم في المملكة المتحدة عن طريق الخطأ لنقل محلول هيدروكسيد الصوديوم بنسبة 25%،[23] مما يتسبب في ارتفاع ضغط المحتويات وتلف الصهاريج. ويعود هذا الضغط إلى غاز الهيدروجين الناتج عن تفاعل هيدروكسيد الصوديوم مع الألومنيوم.
- 2 Al + 2 NaOH + 6 H
2O → 2 Na[Al(OH)
4] + 3 H
2
المترسبات
بخلاف هيدروكسيد الصوديوم القابل للذوبان، فإن هيدروكسيدات معظم الفلزات الانتقالية غير قابلة للذوبان، ولذلك يمكن استخدام هيدروكسيد الصوديوم لترسيب هيدروكسيدات الفلزات الانتقالية. نلاحظ الألوان التالية:
- النحاس- الأزرق
- ثاني أكسيد الحديد - الأخضر
- ثالث أكسيد الحديد - الأصفر/البني
تذوب أملاح الزنك والرصاص في هيدروكسيد الصوديوم الزائد لتنتج محلول نقي من Na
2ZnO
2 أو Na
2PbO
2.
يُستخدم هيدروكسيد الألومنيوم كمروب جيلاتيني لتصفية الجسيمات في معالجة المياه. يُحضّر هيدروكسيد الألومنيوم في محطة المعالجة من كبريتات الألومنيوم بتفاعلها مع هيدروكسيد الصوديوم أو بيكربونات الصوديوم.
- Al
2(SO
4)
3 + 6 NaOH → 2 Al(OH)
3 + 3 Na
2SO
4 - Al
2(SO
4)
3 + 6 NaHCO
3 → 2 Al(OH)
3 + 3 Na
2SO
4 + 6 CO
2
التصبن
يمكن استخدام هيدروكسيد الصوديوم في عملية التحلل المائي للإسترات (وتسمى أيضاً التصبن)، والأميدات، وهاليدات الألكيل.[14] مع ذلك، فإن ذوبان هيدروكسيد الصوديوم المحدود في المذيبات العضوية يعني أن هيدروكسيد البوتاسيوم (KOH) الأكثر قابلية للذوبان يُفضل استخدامه. يُسبب الشعور باللزق عند ملامسة اليدين لمحلول هيدروكسيد الصوديوم، وإن كان غير مُوصى به. يحدث هذا لأن زيوت الجلد، مثل الزهم، تتحول إلى صابون.
على الرغم من قابلية الذوبان في گليكول الپروپيلين، فمن غير المرجح أن يحل محل الماء في التصبن بسبب التفاعل الأساسي لگليكول الپروپيلين مع الدهون قبل التفاعل بين هيدروكسيد الصوديوم والدهون.
| الكسر الكتلي لهيدروكسيد الصوديوم (wt%) | 4 | 10 | 20 | 30 | 40 | 50 |
|---|---|---|---|---|---|---|
| التركيز المولي لهيدروكسيد الصوديوم (M) | 1.04 | 2.77 | 6.09 | 9.95 | 14.30 | 19.05 |
| التركيز الكتلي لهيدروكسيد الصوديوم (جم/لتر) | 41.7 | 110.9 | 243.8 | 398.3 | 572.0 | 762.2 |
| كثافة المحلول (جم/مول) | 1.043 | 1.109 | 1.219 | 1.328 | 1.430 | 1.524 |
التحضير
يُحضر هيدروكسيد الصوديوم صناعياً، أولاً كمحلول بنسبة 32%، ثم يتم تبخيره إلى محلول بنسبة 50% من خلال اختلافات في عملية الكلور-القلوي التي تعتمد على التحليل الكهربائي.[24] غاز الكلور هو المنتج الرئيسي من هذه العملية.[25][24] يُستخرج هيدروكسيد الصوديوم الصلب من هذا المحلول عن طريق تبخير الماء. يُباع هيدروكسيد الصوديوم الصلب عادة على شكل رقائق، وحبيبات، وكتل مصبوبة.[26]
عام 2022، قُدِّر الإنتاج العالمي من هيدروكسيد الصوديوم بنحو 83 مليون طن جاف، وقُدِّر الطلب بنحو 51 مليون طن.[26] عام 1998، بلغ إجمالي الإنتاج العالمي حوالي 45 مليون طن. ساهمت كل من أمريكا الشمالية وآسيا بحوالي 14 مليون طن، بينما أنتجت أوروپا حوالي 10 مليون طن. في الولايات المتحدة، تُعدّ شركة أولين المنتج الرئيسي لهيدروكسيد الصوديوم، حيث يبلغ إنتاجها السنوي حوالي 5.7 مليون طن من مواقع في فريپورت، تكساس؛ پلاكمين، لويزيانا؛ سانت گابرييل، لويزيانا؛ ماكنتوش، ألباما؛ تشارلستون، تنسي؛ نياگرا فولز، نيويورك؛ وبيكانكور، كيبيك. من بين كبار المنتجين الأمريكيين الآخرين أوكسيكم، وستليك، شينتك، وفورموزا. جميع هذه الشركات تستخدم عملية الكلور-القلوي.[27]
تاريخياً، كان هيدروكسيد الصوديوم يُنتج بمعالجة كربونات الصوديوم مع هيدروكسيد الكالسيوم (الجير المطفي) في تفاعل استبدالي، مستفيداً من قابلية هيدروكسيد الصوديوم للذوبان، بينما كربونات الكالسيوم ليست كذلك. سُميت هذه العملية بالكي.[28]
- Ca(OH)
2(aq) + Na
2CO
3(s) → CaCO
3(s) + 2 NaOH(aq)
كانت كربونات الصوديوم لهذا التفاعل تُنتج بواسطة عملية لوبلان في أوائل القرن التاسع عشر، أو عملية سولڤاي في أواخره. استُبدل تحويل كربونات الصوديوم إلى هيدروكسيد الصوديوم كلياً بعملية الكلور-القلوي، التي تُنتج هيدروكسيد الصوديوم في عملية واحدة.
يُنتَج هيدروكسيد الصوديوم أيضاً بخلط معدن الصوديوم النقي مع الماء. النواتج الثانوية هي غاز الهيدروجين والحرارة، مما يؤدي غالباً إلى اشتعال اللهب.
- 2 Na(s) + 2 H
2O(l) → 2 NaOH(aq) + H
2(g)
يستخدم هذا التفاعل عادة لإظهار تفاعلية الفلزات القلوية في البيئات الأكاديمية؛ ومع ذلك، لا يُستخدم تجارياً باستثناء التفاعل داخل عملية الكلور-القلوي ببطارية الزئبق حيث تتفاعل ملغمة الصوديوم مع الماء.
الاستخدامات
هيدروكسيد الصوديوم هو قاعدة قوية شائعة الاستخدام في الصناعة. يُستخدم هيدروكسيد الصوديوم في تصنيع أملاح الصوديوم والمنظفات، وتنظيم الأس الهيدروجيني (pH)، والتركيب العضوي. يُتداول بكميات كبيرة غالباً كمحلول مائي،[29] لأن الحلول أرخص وأسهل في التداول.
يُستخدم هيدروكسيد الصوديوم في العديد من الحالات التي يفضل فيها زيادة قلوية خليط ما، أو معادلة الأحماض. على سبيل المثال، في صناعة النفط، يُستخدم هيدروكسيد الصوديوم كمادة مضافة إلى طين الحفر لزيادة قلويته في أنظمة طين البنتونيت، ولزيادة لزوجته، ومعادلة أي غاز حمضي (مثل كبريتيد الهيدروجين وثاني أكسيد الكربون) قد يتواجد في التكوين الجيولوجي أثناء الحفر. ويُستخدم أيضاً في اختبار رش حيث يلزم تنظيم الأس الهيدروجيني. يُستخدم هيدروكسيد الصوديوم مع حمض الهيدروكلوريك لموازنة الأس الهيدروجيني. الملح الناتج، كلوريد الصوديوم، هو العامل التآكلي المستخدم في اختبار رش الملح القياسي ذي الأس الهيدروجيني المتعادل.
يمكن معالجة النفط الخام رديء الجودة باستخدام هيدروكسيد الصوديوم لإزالة شوائب الكبريت في عملية تُعرف "بالغسل الكاوي". يتفاعل هيدروكسيد الصوديوم مع أحماض ضعيفة مثل كبريتيد الهيدروجين والمركاپتان لإنتاج أملاح صوديوم غير متطايرة، والتي يمكن إزالتها. تُعتبر النفايات الناتجة سامة ويصعب التعامل معها، ولهذا السبب، تُحظر هذه العملية في العديد من البلدان. عام 2006، استخدمت شركة ترافيگورا هذه العملية، ثم ألقت النفايات في ساحل العاج.[30][31]
تشمل الاستخدامات الشائعة الأخرى لهيدروكسيد الصوديوم ما يلي:
- لصنع الصابون والمنظفات. يُستخدم هيدروكسيد الصوديوم في صناعة الصابون الصلب، بينما يُستخدم هيدروكسيد الپوتاسيوم في صناعة الصابون السائل.[32][33] يُستخدم هيدروكسيد الصوديوم أكثر من هيدروكسيد الپوتاسيوم لأنه أرخص ويُستخدم منه كمية أقل.
- كمنظف للمصارف يحول الدهون والشحوم التي تسد الأنابيب إلى صابون يذوب في الماء.
- لصنع الألياف النسيجية الاصطناعية مثل الرايون.
- في صناعة الورق. يُستخدم حوالي 56% من هيدروكسيد الصوديوم المُنتَج في الصناعة، ويُستخدم 25% منه في صناعة الورق.
- في تنقية خام البوكسيت الذي يُستخرج منه فلز الألومنيوم. تُعرف هذه العملية بعملية باير.
- إزالة الشحوم من الفلزات.
- تكرير النفط.
- صنع الأصباغ ومساحيق التبييض.
- تنظيم الأس الهيدروجيني في محطات معالجة المياه.
- لمعالجة عجينة البيگل والپرتزل، مما يمنحها مظهراً لامعاً مميزاً.
لب الورق
يُستخدم هيدروكسيد الصوديوم أيضاً على نطاق واسع في معالجة الخشب لإنتاج الورق أو الألياف المجددة. إلى جانب كبريتيد الصوديوم، يُعد هيدروكسيد الصوديوم مكوناً رئيسياً في محلول السائل الأبيض المستخدم لفصل الليگنين عن ألياف السليولوز في عملية كرافت. كما يلعب دوراً رئيسياً في عدة مراحل لاحقة من عملية تبييض لب الورق البني، الناتج عن عملية المعالجة. تشمل هذه المراحل إزالة اللگنين بالأكسجين، والاستخلاص بالتأكسد، والاستخلاص البسيط، وجميعها تتطلب بيئة قلوية قوية بأس هيدروجيني (pH) > 10.5 في نهاية كل مرحلة.
إذابة الأنسجة
بطريقة مماثلة، يُستخدم هيدروكسيد الصوديوم لهضم الأنسجة، كما في عملية استُخدمت مع حيوانات المزرعة سابقاً. تتضمن هذه العملية وضع الذبيحة في حجرة مغلقة، ثم إضافة خليط من هيدروكسيد الصوديوم والماء (الذي يكسر الروابط الكيميائية التي تحافظ على سلامة اللحم). يؤدي هذا في النهاية إلى تحول الجسم إلى سائل ذي لون بني داكن،[34][35] ولا يتبقى من المواد الصلبة إلا قشور العظام، والتي يمكن سحقها بين أطراف الأصابع.[36]
يستخدم هيدروكسيد الصوديوم بشكل متكرر في عملية تحلل الحيوانات النافقة على الطريق التي يُلقى بها في مكبات النفايات بواسطة مقاولي التخلص من الحيوانات.[35] بفضل توفره وانخفاض تكلفته، استخدمه المجرمون للتخلص من الجثث. استخدمت القاتلة المتسلسلة الإيطالية ليوناردا سيانشيولي هذه المادة الكيميائية لتحويل الجثث إلى صابون.[37] في المكسيك، اعترف رجل كان يعمل مع عصابات المخدرات بالتخلص من أكثر من 300 جثة باستخدام هيدروكسيد الصوديوم.[38]
هيدروكسيد الصوديوم هي مادة كيميائية خطيرة نظراً لقدرتها على تحليل الپروتين. في حال انسكاب محلول مخفف على الجلد، قد تحدث حروق إذا لم تُغسل المنطقة جيداً بالماء الجاري لعدة دقائق. أما تناثر الرذاذ في العين، فقد يكون أكثر خطورة وقد يؤدي إلى العمى.[39]
إذابة المعادن والمركبات التذبذبية
تهاجم القواعد القوية الألومنيوم. يتفاعل هيدروكسيد الصوديوم مع الألومنيوم والماء مُطلقاً غاز الهيدروجين. يأخذ الألومنيوم ذرة أكسجين من هيدروكسيد الصوديوم، والذي بدوره يأخذ ذرة أكسجين من الماء، مُطلقاً ذرتي هيدروجين. ينتج عن هذا التفاعل غاز الهيدروجين وألومينات الصوديوم. في هذا التفاعل، يعمل هيدروكسيد الصوديوم كعامل لجعل المحلول قلوياً، وهو ما يُذيب الألومنيوم.
- 2 Al + 2 NaOH + 2 H
2O → 2 NaAlO
2 + 3 H
2
ألومينات الصوديوم هي مادة كيميائية غير عضوية تُستخدم كمصدر فعال لهيدروكسيد الألومنيوم في العديد من التطبيقات الصناعية والتقنية. ألومينات الصوديوم النقية (اللامائية) مادة صلبة بلورية بيضاء لها صيغ كيميائية مختلفة: NaAlO
2، Na
3AlO
3، Na[Al(OH)
4]، Na
2O·Al
2O
3، أو Na
2Al
2O
4. يُحظر رباعي هيدروكسوالومينات الصوديوم (III) أو ألومينات الصوديوم المائية بالمعادلة التالية:[40]
- 2 Al + 2 NaOH + 6 H
2O → 2 Na[Al(OH)
4] + 3 H
2
يمكن أن يكون هذا التفاعل مفيداً في التنميش، أو إزالة الأكسدة، أو منح السطح المصقول لمسة نهائية تشبه الساتان، لكن بدون المزيد من التخميل مثل الأنودة أو الألدنة، قد يتدهور السطح، إما تحت الاستخدام العادي أو في الظروف الجوية القاسية.
في عملية باير، يُستخدم هيدروكسيد الصوديوم في تنقية الخامات المحتوية على الألومينا (البوكسيت) لإنتاج الألومينا (أكسيد الألومنيوم)، وهي المادة الخام المستخدمة لإنتاج الألومنيوم عبر عملية هال-هيرو بالتحليل الكهربائي. ولأن الألومينا متذبذبة كيميائياً، فهي تذوب في هيدروكسيد الصوديوم، تاركةً شوائب أقل قابلية للذوبان عند ارتفاع الأس الهيدروجيني، مثل أكاسيد الحديد، على شكل طين أحمر شديد القلوية.
الفلزات المتذبذبة الأخرى هي الزنك والرصاص والتي تذوب في محاليل هيدروكسيد الصوديوم المركزة لإعطاء زنكات الصوديوم وپلومبات الصوديوم على التوالي.
كاشف الأسترة والأسترة التبادلية
يستخدم هيدروكسيد الصوديوم تقليديا في صناعة الصابون (تصنيع الصابون على البارد، التصبن).[41] كان يُصنع في القرن التاسع عشر ليكون على الشكل الصلب وليس منتجاً سائلاً لأنه كان أسهل في التخزين والنقل.
لتصنيع الديزل الحيوي، يُستخدم هيدروكسيد الصوديوم كمحفز لعملية الأسترة التبادلية للميثانول وثلاثي الگليسريد. لا ينجح هذا إلا مع هيدروكسيد الصوديوم اللامائي، لأن الدهون عند مزجها بالماء ستتحول إلى صابون، والذي قد يتلوث بالميثانول. يُستخدم هيدروكسيد الصوديوم أكثر من هيدروكسيد الپوتاسيوم نظراً لرخص ثمنه واستخدامه بكميات أقل في عملية التصنيع. ونظراً لتكاليف الإنتاج، يُعد هيدروكسيد الصوديوم، الذي يُنتج باستخدام ملح الطعام، أرخص من هيدروكسيد الپوتاسيوم.[42]
منتجات العناية بالبشرة
يستخدم هيدروكسيد الصوديوم في بعض منتجات العناية بالبشرة ومستحضرات التجميل، مثل منظفات الوجه والكريمات واللوشن ومستحضرات التجميل. يُستخدم عادة بتركيز منخفض كمُوازن لدرجة الحموضة (pH)، نظراً لطبيعته القلوية العالية.[43]
تحضير الأغذية
تشمل استخدامات هيدروكسيد الصوديوم في الأغذية غسل أو تقشير الفواكه والخضروات كيميائياً، ومعالجة الشوكولاتة والكاكاو، وإنتاج لون الكراميل، وسلخ الدواجن، ومعالجة المشروبات الغازية، وتكثيف الآيس كريم.[44] غالباً ما يُنقع الزيتون في هيدروكسيد الصوديوم لتليينه؛ ويُدهن الپرتزل ولفائف الخبز الألمانية بمحلول هيدروكسيد الصوديوم قبل الخبز لجعلها مقرمشة. ونظراً لصعوبة الحصول على هيدروكسيد الصوديوم الصالح للأكل بكميات صغيرة للاستخدام المنزلي، غالباً ما تُستخدم كربونات الصوديوم بدلاً من هيدروكسيد الصوديوم.[45] وتُعرف بالرقم E E524.
تشمل الأغذية المعالجة بهيدروكسيد الصوديوم ما يلي:
- تُسلق الپرتزل الألمانية في محلول كربونات الصوديوم المغلي أو محلول هيدروكسيد الصوديوم البارد قبل الخبز، مما يساهم في تكون قشرتها الفريدة.
- يعتبر ماء هيدروكسيد الصوديوم مكوناً أساسياً في قشرة كعك القمر الصيني التقليدي المخبوز.
- معظم الشعيرية الصينية ذات اللون الأصفر مصنوعة من ماء هيدروكسيد الصوديوم لكن يُخلط بين ذلك وبين احتوائها على البيض.
- يستخدم أحد أنواع الزونگتسي ماء هيدروكسيد الصوديوم لإضفاء نكهة حلوة.
- يسبب هيدروكسيد الصوديوم تجمد بياض البيض أثناء إنتاج بيض القرن.
- تتضمن بعض طرق تحضير الزيتون تعريضه لمحلول ملحي يحتوي على هيدروكسيد الصوديوم.[46]
- تستخدم الحلوى الفلپينية (الكاكانين) المسماة كوتسينتا كمية قليلة من ماء هيدروكسيد الصوديوم لمنح عجينة دقيق الأرز قواماً هلامياً. تُستخدم عملية مماثلة أيضاً في الكاكانين المعروفة باسم پيتسي-پيتسي أو پيتشي-پيتشي، إلا أن الخليط يستخدم الكاساڤا المبشورة بدلاً من دقيق الأرز.
- طبق نرويجي يُعرف باسم لوت فيش.
- عادة ما تُسلق أرغفة البيگل في محلول هيدروكسيد الصوديوم قبل الخبز، مما يسهم في إكسابها قشرة لامعة.
- الهوميني هو حبوب ذرة مجففة تُعاد تشكيلها بالنقع في ماء هيدروكسيد الصوديوم. يتمدد حجمها بشكل كبير، ويمكن معالجتها بالقلي لصنع الذرة المحمصة أو بالتجفيف والطحن لصنع عصيدة الذرة. يُستخدم الهوميني في صنع دقيق المسة، وهو دقيق شائع الاستخدام في المطبخ المكسيكي لصنع تورتيلا الذرة والتمال. وهو يشبهه النكسيتمال، لكنه يستخدم هيدروكسيد الكالسيوم بدلاً من هيدروكسيد الصوديوم.
مواد التنظيف
يُستخدم هيدروكسيد الصوديوم بكثرة كمنظف صناعي، ويُطلق عليه غالباً اسم "الصودا الكاوية". يُضاف إلى الماء، ويُسخّن، ثم يُستخدم لتنظيف معدات العمليات، وخزانات التخزين، وغيرها. له القدرة على إذابة الشحوم، والزيوت، والدهون، والرواسب الپروتينية. كما يُستخدم لتنظيف أنابيب تصريف النفايات تحت الأحواض والمصارف في المنازل.
يمكن إضافة المواد الخافضة للتوتر السطحي إلى محلول هيدروكسيد الصوديوم لتثبيت المواد المذابة ومنع إعادة الترسب. يُستخدم محلول نقع هيدروكسيد الصوديوم كمزيل شحوم قوي على أواني الخبز المصنوعة من الصلب المقاوم للصدأ والزجاج. كما أنه مكون شائع في منظفات الأفران.
يُستخدم هيدروكسيد الصوديوم بشكل شائع في إنتاج منظفات غسالات الأجزاء. تُعد منظفات غسالات الأجزاء المصنوعة من هيدروكسيد الصوديوم من أكثر المواد الكيميائية فعالية في تنظيف غسالات الأجزاء. تشمل المنظفات القائمة على هيدروكسيد الصوديوم مواد خافضة للتوتر السطحي، ومثبطات الصدأ، ومزيلات الرغوة. تُسخّن غسالة الأجزاء الماء والمنظف في خزانة مغلقة، ثم تُرشّ هيدروكسيد الصوديوم الساخن والماء الساخن تحت ضغط على الأجزاء المتسخة لإزالة الشحوم. استُبدل هيدروكسيد الصوديوم المستخدم بهذه الطريقة بالعديد من الأنظمة القائمة على المذيبات في أوائل التسعينيات[citation needed] عندما حُظر استخدام ثلاثي كلورو الإيثان بموجب پروتوكول مونتريال. تُعتبر غسالات الأجزاء القائمة على الماء وهيدروكسيد الصوديوم المُنظفة صديقة للبيئة مقارنةً بطرق التنظيف القائمة على المذيبات.
يُستخدم هيدروكسيد الصوديوم في المنازل كنوع من مسلكات الصرف الصحي المسدودة، عادةً على شكل بلورة جافة أو جل سائل كثيف. يتفاعل القلوي مع الشحوم لإنتاج صابون وجلسرين قابلين للذوبان في الماء. كما يُحلل الپروتينات، مثل تلك الموجودة في الشعر، والتي قد تسد أنابيب الصرف الصحي. يعد إذابة هيدروكسيد الصوديوم في الماء تفاعلاً طارداً للحرارة، يُنتج كميات كبيرة من الحرارة، مما يُساعد على تسريع التفاعلات مع الشحوم والمواد العضوية الأخرى. منظفات الصرف الصحي القلوية ووالأنواع الحمضية منها تعتبر مواد شديدة التآكل ويجب التعامل معها بحذر شديد.
فرد الشعر
يُستخدم هيدروكسيد الصوديوم في بعض المرخيات لفرد الشعر. ومع ذلك، نظراً لارتفاع معدل حدوث الحروق الكيميائية وشدتها، يستخدم مُصنِّعو مُرخيات الشعر الكيميائية مواد كيميائية قلوية أخرى في مستحضراتهم المتاحة للمستهلكين. لا تزال مُرخيات هيدروكسيد الصوديوم متوفرة، لكن يستخدمها في الغالب المحترفون.
مزيل الطلاء
كان محلول هيدروكسيد الصوديوم في الماء يُستخدم تقليدياً كمزيل طلاء شائع للخشب. لكن استخدامه أصبح أقل شيوعاً الآن، لأنه قد يُتلف سطح الخشب، ويُبرز عروق الخشب، ويُلطخ اللون.
معالجة المياه
يُستخدم هيدروكسيد الصوديوم أحياناً أثناء تنقية المياه لرفع الأس الهيدروجيني مصادر المياه. يُقلل ارتفاع الأس الهيدروجيني من تآكل المياه في أنابيب الصرف الصحي، ويُقلل من كمية الرصاص والنحاس والمعادن السامة الأخرى التي قد تذوب في مياه الشرب.[47][48]
الاستخدامات التاريخية
تاريخياً، أُستخدم هيدروكسيد الصوديوم للكشف عن التسمم بأول أكسيد الكربون، حيث تتحول عينات الدم من هؤلاء المرضى إلى اللون الأحمر الناصع عند إضافة بضع قطرات من هيدروكسيد الصوديوم.[49] اليوم، يُكشف عن التسمم بأول أكسيد الكربون عن طريق مقياس أول أكسيد الكربون بالدم.
في خلطات الأسمنت، الملاط، الخرسانة، والجص
يُستخدم هيدروكسيد الصوديوم في بعض ملينات خلطات الأسمنت. يساعد هذا على تجانس خلطات الأسمنت، ومنع انفصال الرمال والأسمنت، وتقليل كمية الماء اللازمة في الخلطة، وزيادة قابلية تشغيل منتج الأسمنت، سواء كان ملاط أو جص أو خرسانة.
الإنتاج
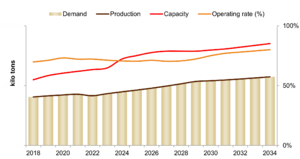
عام 2023، بلغ حجم سوق الصودا الكاوية 88.700.000 طن، بمعدل نمو سنوي متوسط قدره 2% منذ عام 2018. ومن المتوقع أن ينمو بمعدل نمو سنوي مركب قدره 2.8% ليصل إلى أكثر من 116.202.000 طن بحلول عام 2034. من المتوقع أن تتجاوز طاقة إنتاج الصودا الكاوية 130.700.000 طن (بدون توقعات) بحلول عام 2034، وذلك بفضل التوسعات الإنتاجية في منطقة آسيا-الهادي لتلبية الطلب المتزايد على الصودا الكاوية من مختلف الصناعات ذات الاستخدام النهائي. تُعد منطقة آسيا-الهادي أكبر منتج للصودا الكاوية، حيث تُمثل حوالي 60% من الطاقة الإنتاجية العالمية، تليها أمريكا الشمالية بنسبة 16% تقريباً. وتستحوذ جميع المناطق الأخرى، بما في ذلك غرب ووسط وشرق أوروپا، وأمريكا الوسطى والجنوبية، والشرق الأوسط وأفريقيا، على الحصة المتبقية من الطاقة الإنتاجية العالمية للصودا الكاوية.[50]
عام 2023 قُدر الطلب العالمي على الصودا الكاوية بنحو 88.700.000 طن، ومن المتوقع أن ينمو بالتوازي مع نمو الناتج المحلي الإجمالي خلال الفترة المتوقعة 2024-2034. وقد استحوذت منطقتا آسيا-الهادي وأمريكا الشمالية معاً على أكثر من 70% من الطلب العالمي على الصودا الكاوية. وخلال الفترة المتوقعة، من المتوقع أن تشهد منطقة آسيا-الهادي زيادة في استهلاك تطبيقات مثل أكسيد الألومنيوم النسيجي، وبطاريات السيارات الكهربائية، والمستحضرات الصيدلانية، وغيرها.
من حيث الطلب، في منطقة آسيا-الهادي، تُمثّل الصين الحصة الأكبر في المنطقة، تليها اليابان وكوريا الجنوبية والهند. ومن المتوقع أن يتجاوز الطلب في المنطقة 77.500.000 طن خلال الفترة المتوقعة. وبلغ الطلب على الصودا الكاوية في أمريكا الشمالية 11.500.000 طن عام 2023، وهو ما يمثل 13% من الطلب العالمي على الصودا الكاوية. ومن المتوقع أن يشهد معدل نمو سنوي مركب قدره 1.5% ليصل إلى 13.350.000 طن بحلول عام 2034. واستحوذت الولايات المتحدة على 85% من الطلب الإقليمي على الصودا الكاوية، تليها المكسيك وكندا بنحو 7.4% لكل منهما. كما تُعد الولايات المتحدة أكبر مُصدّر للصودا الكاوية، حيث بلغ متوسط صادراتها أكثر من 5.000.000 طن بين عامي 2018 و2022، ومن المتوقع أن تحافظ على هذا الحجم من الصادرات خلال الفترة المتوقعة.
تتمتع الصين بأعلى قدرة إنتاجية للصودا الكاوية في العالم، حيث تمثل ما يقرب من 45% من إجمالي القدرة العالمية - حيث تتجاوز القدرات المثبتة للمنتجين الرئيسيين في البلاد 1.000.000 طن.
أكبر منتجي الصودا الكاوية في الصين:
- تانگشان سانيو للكلور-قلوي
- منغوليا الداخلية جونژنگ للكيماويات
- منغوليا الداخلية ژونگگو للتعدين
- شينگپو للكيماويات
- جيانگسو ميْلان
- شآنشي بيْيوان للصناعات الكيماوية
- مجموعة دونگيينگ للكيماويات
- شينجيانگ ژونگتاي للكيماويات
- وِيْفانگ ياشينگ للكيماويات
عام 2023، بلغ الطلب على الصودا الكاوية في الصين 37.200.000 طن، ما يمثل أكثر من 40% من الطلب العالمي عليها. تُعدّ الصين مُصدّراً صافياً لتجارة الصودا الكاوية، بمتوسط حجم تصدير يتجاوز 1.200.000 طن بين عامي 2018 و2021، معظمها على شكل محاليل مائية. تُعد العديد من الدول، مثل أستراليا وإندونيسيا وڤيتنام والفلپين وسنغافورة والبرازيل، شركاء تجاريين أساسيين للصين. عام 2021، استوردت أستراليا وحدها حوالي 450.000 طن من الصودا الكاوية من الصين، مما يجعلها أكبر مستورد لهذا المنتج. في الوقت نفسه، تُعدّ رابطة دول جنوب شرق آسيا (آسيان) ثاني أكبر مستورد للصودا الكاوية.
تتركز معظم طاقات إنتاج الصودا الكاوية في منطقة آسيا-الهادي، وخاصة الصين. ومن المتوقع أيضاً أن تزيد الصين حصتها السوقية في الصادرات خلال الفترة المتوقعة حتى عام 2034. ومن المتوقع أن تشهد صناعة الكيماويات والألومينا نمواً أسرع مقارنةً بالصناعات الرئيسية الأخرى.
الشركات المصنعة الرئيسية للصودا الكاوية عالمياً:
 ألمانيا: باسف (BASF)
ألمانيا: باسف (BASF) ألمانيا: كوفسرتو (Covestro)
ألمانيا: كوفسرتو (Covestro) ألمانيا: ڤستليكه فينوليت (Westlake Vinnolit)
ألمانيا: ڤستليكه فينوليت (Westlake Vinnolit) إيران: أرواند للپتروكيماويات (Arvand Petrochemical)
إيران: أرواند للپتروكيماويات (Arvand Petrochemical) الهند: ساداف للكيماويات (Sadaf Chemicals)
الهند: ساداف للكيماويات (Sadaf Chemicals) جنوب أفريقيا: ساسول (Sasol)
جنوب أفريقيا: ساسول (Sasol) پاكستان: سيسترا للصناعات الكيماوية (Sitara Chemical Industries Limited)
پاكستان: سيسترا للصناعات الكيماوية (Sitara Chemical Industries Limited) تايوان: فورموسا للبلاستيك (Formosa Plastics
تايوان: فورموسا للبلاستيك (Formosa Plastics اليابان: إي جي سي (AGC)
اليابان: إي جي سي (AGC) اليابان: توسو (Tosoh)
اليابان: توسو (Tosoh) الهند: مجموعة أديتا بيرلا (Aditya Birla Group)
الهند: مجموعة أديتا بيرلا (Aditya Birla Group) الصين: شينگشيانگ ژونگتاي للصناعات الكيماوية (Xinjiang Zhongtai Chemical Industry)
الصين: شينگشيانگ ژونگتاي للصناعات الكيماوية (Xinjiang Zhongtai Chemical Industry) الصين: شنغهاي لكيماويات الكلور-القلوي (Shanghai Chlor-Alkali Chemical)
الصين: شنغهاي لكيماويات الكلور-القلوي (Shanghai Chlor-Alkali Chemical) المجر: بورسودكم (BorsodChem)
المجر: بورسودكم (BorsodChem) الولايات المتحدة: شينتك (Shintech)
الولايات المتحدة: شينتك (Shintech) الولايات المتحدة: داو للكيماويات (Dow)
الولايات المتحدة: داو للكيماويات (Dow)
السلامة
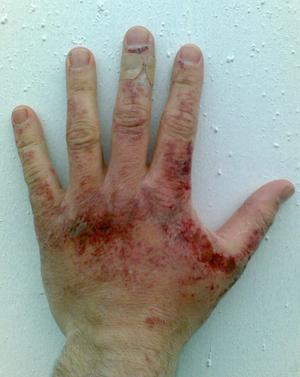
مثل غيرها من الأحماض والقلويات الأكالة، يمكن لبضع قطرات من محاليل هيدروكسيد الصوديوم أن تحلل بسهولة الپروتينات والدهون في الأنسجة الحية عن طريق التحليل المائي للأميدات والإسترات، مما يسبب بالتالي حروقاً كيميائية وقد يسبب العمى الدائم عند ملامسته للعينين.[1][2] يمكن للقلويات الصلبة أن تُظهر طبيعتها التآكلية في وجود الماء، مثل بخار الماء. لذلك، يجب دائماً استخدام معدات الوقاية، مثل القفازات المطاطية وملابس السلامة وواقيات العين، عند التعامل مع هذه المادة الكيميائية أو محاليلها. وتتمثل إجراءات الإسعافات الأولية المعتادة في حالة انسكاب القلوي على الجلد، كما هو الحال مع المواد الأكالة الأخرى، في الري بكميات كبيرة من الماء. ويُستمر الغسل لمدة تتراوح بين عشر وخمس عشرة دقيقة على الأقل.
علاوةً على ذلك، يعد ذوبان هيدروكسيد الصوديوم طارداً للحرارة بدرجة عالية، وقد تُسبب الحرارة الناتجة عنه حروقاً حرارية أو اشتعال المواد القابلة للاشتعال. كما يُنتج حرارةً عند تفاعله مع الأحماض.
هيدروكسيد الصوديوم هو مادة تآكلية خفيفة للزجاج، مما قد يسبب تلفاً التزجيج أو يتسبب في التصاق وصلات الزجاج المطحون.[51] هيدروكسيد الصوديوم هو مادة تآكلية للعديد من الفلزات، مثل الألومنيوم الذي يتفاعل مع القلوي لإنتاج غاز الهيدروجين القابل للاشتعال عند ملامسته.[52]
يتراوح مستوى سمية هيدروكسيد الصوديوم للأسماك وغيرها بين 20 و200 ملجم/لتر، ويرتبط بارتفاع قيمة الأس الهيدروجيني. لكن نظراً لسرعة تحييده وعدم تراكمه، فإن تأثيره على البيئة عادةً ما يكون سهل المعالجة.[53]
التخزين
يُخزن هيدروكسيد الصوديوم عادة في زجاجات للاستخدامات المعملية على نطاق صغير، أو داخل حاويات متوسطة الحجم لمناولة ونقل البضائع، أو داخل خزانات تخزين ثابتة كبيرة بسعة تصل إلى 100.000 جالون للتصنيع أو محطات معالجة مياه الصرف الصحي التي تستخدم هيدروكسيد الصوديوم بكثرة. تشمل المواد الشائعة المتوافقة مع هيدروكسيد الصوديوم، والتي تُستخدم غالباً لتخزين هيدروكسيد الصوديوم، ما يلي: الپولي إيثيلين (HDPE، وهو شائع الاستخدام، وXLPE، وهو أقل شيوعاً)، والصلب الكربوني، والپولي ڤينيل كلوريد (PVC)، والصلب المقاوم للصدأ، والبلاستيك المقوى بالألياف الزجاجية (FRP، مع بطانة مقاومة).[14]
يجب تخزين هيدروكسيد الصوديوم في حاويات محكمة الإغلاق للحفاظ على طبيعته لأنه سيمتص الماء وثاني أكسيد الكربون من الغلاف الجوي.
التاريخ
تم تحضير هيدروكسيد الصوديوم لأول مرة من قبل صانعي الصابون.[54] ظهرت طريقة تحضير هيدروكسيد الصوديوم كجزء من وصفة لصنع الصابون في كتاب عربي يعود إلى أواخر القرن الثالث عشر بعنوان المخترع في فنون من الصنع، من تأليف المظفر الرسولي يوسف بن عمر بن علي (ت. 1295)، ملك اليمن.[55][56]
تتطلب الوصفة تمرير الماء بشكل متكرر عبر خليط من القلوي (ورد في الكتاب باسم "القلي"}}، وهو رماد مستخرج من نبات الخريزة الأوروپية، وهي غنية بالصوديوم؛ وبالتالي فإن القلوي هو كربونات الصوديوم غير النقية)[57] والجير الحي (أكسيد الكالسيوم، CaO)، حيث ينتج محلول من هيدروكسيد الصوديوم. كما اتبع صانعو الصابون الأوروپيون هذه الوصفة. عام 1791، عندما حصل الكيميائي والجراح الفرنسي نيكولا لوبلان (1742-1806) على براءة اختراع لإنتاج كربونات الصوديوم بكميات كبيرة، كان "رماد الصودا" الطبيعي (كربونات الصوديوم غير النقية التي تُستخرج من رماد النباتات الغنية بالصوديوم)[54] قد أُستبدل بهذه النسخة الاصطناعية.[54] ومع ذلك، بحلول القرن العشرين، أصبحت عملية التحليل الكهربائي لكلوريد الصوديوم هي الطريقة الأساسية لإنتاج هيدروكسيد الصوديوم.[58]
انظر أيضاً
وصلات خارجية
- International Chemical Safety Card 0360
- NIOSH Pocket Guide to Chemical Hazards
- European Chemicals Bureau
- Chlorine Online - Facts about Chlorine, Sodium Hydroxide (Caustic Soda) is an important co-product of Chlorine
- The Chlorine Institute, Inc. website
- Sodium hydroxide products of Bayer MaterialScience in North America
- Titration of acids with sodium hydroxide – freeware for data analysis, simulation of curves and pH calculation
المصادر
- ^ أ ب ت "Material Safety Datasheet" (PDF). certified-lye.com. Archived from the original (PDF) on 2008-02-28. Retrieved 2010-02-24.
- ^ أ ب ت "Material Safety Datasheet 2" (PDF). hillbrothers.com. Archived from the original (PDF) on 2012-08-03. Retrieved 2012-05-20.
- ^ أ ب "Sodium Hydroxide – Compound Summary". Retrieved June 12, 2012.
- ^ أ ب Haynes, p. 4.90
- ^ Smith, R.M.; Martell, A.E. and Motekaitis, R.J. (2001). "NIST Critical Stability Constants of Metal Complexes". NIST Gaithersburg, MD. Database 46.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Neils, T.L.; Schaertel, S. and Silverstein, T.P. (2024). "The pKa of Water and the Fundamental Laws Describing Solution Equilibria: An Appeal for a Consistent Thermodynamic Pedagogy". Helv. Chim. Acta. 107 (11). doi:10.1002/hlca.202400103.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Haynes, p. 4.135
- ^ أ ب ت NIOSH Pocket Guide to Chemical Hazards 0565
- ^ Michael Chambers. "ChemIDplus – 1310-73-2 – HEMHJVSKTPXQMS-UHFFFAOYSA-M – Sodium hydroxide [NF] – Similar structures search, synonyms, formulas, resource links, and other chemical information.". nih.gov.
- ^ "Sodium hydroxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ أ ب ت ث ج ح خ Siemens, P. R.; Giauque, William F. (1969). "Entropies of the hydrates of sodium hydroxide. II. Low-temperature heat capacities and heats of fusion of NaOH·2H2O and NaOH·3.5H2O". Journal of Physical Chemistry. 73 (1): 149–157. doi:10.1021/j100721a024.
- ^ "Examples of Common Laboratory Chemicals and their Hazard Class". Archived from the original on 2018-01-10. Retrieved 2018-01-09.
- ^ "Caustic Soda Market Size, Growth, Trends & Forecast, 2034".
- ^ أ ب ت ث "Sodium Hydroxide Storage Tanks & Specifications". Protank (in الإنجليزية الأمريكية). 2018-09-08. Retrieved 2018-11-21.
- ^ "Exothermic vs. Endothermic: Chemistry's Give and Take". Discovery Express Kids. August 29, 2014. Archived from the original on March 28, 2023. Retrieved March 28, 2023.
- ^ أ ب ت ث ج ح خ د ذ ر ز Umfreville Pickering, Spencer (1893). "LXI.—The hydrates of sodium, potassium, and lithium hydroxides". Journal of the Chemical Society, Transactions. 63: 890–909. doi:10.1039/CT8936300890.
- ^ أ ب ت ث ج Mraw, S. C.; Giauque, W. F. (1974). "Entropies of the hydrates of sodium hydroxide. III. Low-temperature heat capacities and heats of fusion of the α and β crystalline forms of sodium hydroxide tetrahydrate". Journal of Physical Chemistry. 78 (17): 1701–1709. doi:10.1021/j100610a005.
- ^ أ ب ت ث Murch, L. E.; Giauque, W. F. (1962). "The thermodynamic properties of sodium hydroxide and its monohydrate. Heat capacities to low temperatures. Heats of solution". Journal of Physical Chemistry. 66 (10): 2052–2059. doi:10.1021/j100816a052.
- ^ Brodale, G. E.; Giauque, W. F. (1962). "The freezing point-solubility curve of aqueous sodium hydroxide in the region near the anhydrous-monohydrate eutectic". Journal of Physical Chemistry. 66 (10): 2051. doi:10.1021/j100816a051.
- ^ M. Conde Engineering: "Solid-Liquid Equilibrium (SLE) and Vapour-Liquid Equilibrium (VLE) of Aqueous NaOH Archived 2020-10-07 at the Wayback Machine". Online report, accessed on 2017-04-29.
- ^ Jacobs, H. and Metzner, U. (1991). "Ungewöhnliche H-Brückenbindungen in Natriumhydroxidmonohydrat: Röntgen- und Neutronenbeugung an NaOH·H<sub">2</sub">O bzw. NaOD·D<sub">2</sub">O". Zeitschrift für anorganische und allgemeine Chemie. 597 (1): 97–106. doi:10.1002/zaac.19915970113.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ 祖恩, 许 (1992), 钾素,钾肥溯源[J]
- ^ Stamell, Jim (2001), EXCEL HSC Chemistry, Pascal Press, pp. 199, ISBN 978-1-74125-299-6
- ^ أ ب Fengmin Du, David M Warsinger, Tamanna I Urmi, Gregory P Thiel, Amit Kumar, John H Lienhard (2018). "Sodium hydroxide production from seawater desalination brine: process design and energy efficiency". Environmental Science & Technology. 52 (10): 5949–5958. Bibcode:2018EnST...52.5949D. doi:10.1021/acs.est.8b01195. hdl:1721.1/123096. PMID 29669210.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ "Sodium Hydroxide Supply Chain – Executive Summary" (PDF). United States Environmental Protection Agency. December 2022.
- ^ أ ب Cetin Kurt, Jürgen Bittner. "Sodium Hydroxide". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_345.pub2.
{{cite encyclopedia}}: Cite has empty unknown parameter:|authors=(help) - ^ Kirk-Othmer Encyclopedia of Chemical Technology[dead link], 5th edition, John Wiley & Sons
- ^ Deming, Horace G. (1925). General Chemistry: An Elementary Survey Emphasizing Industrial Applications of Fundamental Principles (2nd ed.). New York: John Wiley & Sons, Inc. p. 452.
- ^ "Document 2 - CausticSodamanual2008.pdf" (PDF). 2013. Archived from the original (PDF) on March 19, 2015. Retrieved July 17, 2014.
- ^ Sample, Ian (16 September 2009). "Trafigura case: toxic slop left behind by caustic washing". The Guardian. Retrieved 2009-09-17.
- ^ "Trafigura knew of waste dangers". BBC Newsnight. 16 September 2009. Retrieved 2009-09-17.
- ^ "A Guide to Caustic Chemicals Used in Soap Making | Brenntag". www.brenntag.com (in الإنجليزية). Retrieved 2020-10-03.
- ^ "Sodium Hydroxide | Uses, Benefits, and Chemical Safety Facts". ChemicalSafetyFacts.org (in الإنجليزية الأمريكية). 2016-09-06. Retrieved 2020-10-03.
- ^ Ayres, Chris (27 February 2010) Clean green finish that sends a loved one down the drain Times Online. Retrieved 2013-02-20.
- ^ أ ب Thacker, H. Leon; Kastner, Justin (August 2004). Carcass Disposal: A Comprehensive Review. Chapter 6 Archived 2017-02-02 at the Wayback Machine. National Agricultural Biosecurity Center, Kansas State University, 2004. Retrieved 2010-03-08
- ^ Roach, Mary (2004). Stiff: The Curious Lives of Human Cadavers, New York: W.W. Norton & Company. ISBN 0-393-32482-6.
- ^ "Sodium:Getting rid of dirt – and murder victims". BBC News. 3 May 2014.
- ^ William Booth (January 27, 2009). "'Stewmaker' Stirs Horror in Mexico". Washington Post.
- ^ "ATSDR – Medical Management Guidelines (MMGs): Sodium Hydroxide". www.atsdr.cdc.gov. Archived from the original on May 28, 2010.
- ^ PubChem. "Aluminium sodium tetrahydroxide". pubchem.ncbi.nlm.nih.gov (in الإنجليزية). Retrieved 2020-10-03.
- ^ Morfit, Campbell (1856). A treatise on chemistry applied to the manufacture of soap and candles. Parry and McMillan.
- ^ "Side by Side Comparison: Potassium Hydroxide and Sodium Hydroxide - Similarities, Differences and Use Cases". info.noahtech.com (in الإنجليزية الأمريكية). Archived from the original on 2020-10-10. Retrieved 2020-10-03.
- ^ "Safety Assessment of Inorganic Hydroxides as Used in Cosmetics" (PDF). cir-safety.org. 2015. Retrieved May 12, 2024.
- ^ "Sodium Hydroxide". rsc.org. 2014. Retrieved November 9, 2014.
- ^ "Hominy without Lye". National Center for Home Food Preservation. Archived from the original on 2011-09-11. Retrieved 2019-01-15.
- ^ "Olives: Safe Methods for Home Pickling (application/pdf Object)" (PDF). ucanr.org. 2010. Archived from the original (PDF) on January 17, 2012. Retrieved January 22, 2012.
- ^ "Drinking Water Treatment – pH Adjustment". 2011. Archived from the original on August 10, 2018. Retrieved June 23, 2016.
- ^ Brian Oram, PG (2014). "Drinking Water Issues Corrosive Water (Lead, Copper, Aluminum, Zinc and More)". Archived from the original on July 1, 2016. Retrieved June 23, 2016.
- ^ Page 168 in: The Detection of poisons and strong drugs. Author: Wilhelm Autenrieth. Publisher: P. Blakiston's son & Company, 1909.
- ^ "Caustic Soda Market Analysis By Demand, By Region, By Applications and Forecast Report Till 2034". prismaneconsulting.com. Retrieved 2025-04-23.
- ^ Pubchem. "SODIUM HYDROXIDE | NaOH – PubChem". pubchem.ncbi.nlm.nih.gov. Retrieved 2016-09-04.
- ^ "aluminium_water_hydrogen.pdf (application/pdf Object)" (PDF). www1.eere.energy.gov. 2008. Archived from the original (PDF) on September 14, 2012. Retrieved January 15, 2013.
- ^ "NaOH - Summary Risk Assessment Report . CAS No: 1310-73-2". Institute for Health and Consumer Protection. 2008.
Chapter 3, aquatic environment
- ^ أ ب ت Thorpe, Thomas Edward, ed., A Dictionary of Applied Chemistry (London, England: Longmans, Green, and Co., 1913), vol. 5, [1]
- ^ See: History of Science and Technology in Islam: Description of Soap Making Archived 2020-08-07 at the Wayback Machine
- ^ The English chemist and archaeologist Henry Ernest Stapleton (1878–1962) presented evidence that the Persian alchemist and physician Muhammad ibn Zakariya al-Razi (c. 865–925) knew about sodium hydroxide. See Stapleton, Henry E.; Azo, R.F.; Hidayat Husain, M. (1927). "Chemistry in Iraq and Persia in the Tenth Century A.D." Memoirs of the Asiatic Society of Bengal. VIII (6): 317–418. OCLC 706947607. p. 322.
- ^ Stapleton, Henry E.; Azo, R.F. (1905). "Alchemical equipment in the eleventh century, A.D." Memoirs of the Asiatic Society of Bengal. I (4): 47–71. See footnote 5 on p. 53. From p. 53: "5. Sodium carbonate. Qily is the ashes of certain plants, e.g. Salsola and Salicornia … , which grow near the sea, or in salty places … "
- ^ O'Brien, Thomas F.; Bommaraju, Tilak V. and Hine, Fumio (2005) Handbook of Chlor-Alkali Technology, vol. 1. Berlin, Germany: Springer. Chapter 2: History of the Chlor-Alkali Industry, p. 34. ISBN 9780306486241
مراجع عامة
- International Chemical Safety Card 0360
- Euro Chlor-How is chlorine made? Chlorine Online
- NIOSH Pocket Guide to Chemical Hazards
- CDC – Sodium Hydroxide – NIOSH Workplace Safety and Health Topic
- Production by brine electrolysis
- Data sheets
- Titration of acids with sodium hydroxide; freeware for data analysis, simulation of curves and pH calculation
- Caustic soda production in continuous causticising plant by lime soda process
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- Articles with dead external links from October 2022
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- Chemical articles with unknown parameter in Chembox
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from May 2010
- هندسة كيماوية
- Cleaning products
- مواد مذوبة
- مركبات الصوديوم
- كيماويات منزلية
- مركبات غير عضوية
- هيدروكسيدات
- مجففات
- مضافات غذائية بأرقام أوروپية
- منظمات حموضة الطعام